题目内容
13.可逆反应:2NO2(g)?2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n mol NO | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 混合气体的颜色不再改变的状态 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.单位时间内生成n mol O2的同时生成2n mol NO2,该反应达到平衡状态,但单位时间内生成n mol O2的同时生成n mol NO2该反应一定没有达到平衡状态,故A错误;
B.无论发生是否达到平衡状态都存在单位时间内生成n mol O2的同时生成2n mol NO,所以不能据此判断平衡状态,故B错误;
C.反应前后气体质量不变、容器体积不变,所以密度始终不变,所以不能根据密度判断平衡状态,故C错误;
D.混合气体的颜色不再改变的状态时,二氧化氮的浓度越大,则正反应速率相等,该反应达到平衡状态,故D正确;
故选D.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,否则不能作为判断依据,为易错题.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
1.某同学欲配制含下列不同阴、阳离子的混合溶液,其中能配制成功的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | NH4+、I-、K+、OH- | D. | Cu2+、Na+、S2-、SO42- |
3.下列说法正确的是( )
| A. | 能自发进行的化学反应,一定是△H<0,△S>0 | |
| B. | 常温下5.0×10-3mol•L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(0H)2(s)?M2+(aq)+2OH-(aq) Ksp=a;c(M2+)=bmol•L-1时,溶液的pH等于14+$\frac{1}{2}$lg($\frac{b}{a}$) | |
| D. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
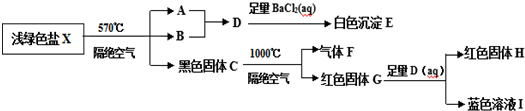
 .
.
 .
. .
.