题目内容
(2010?大连二模)燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池,除氢气外,烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料.请回答下列问题:
(1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池.写出其正极反应式
(2)以上述电池为电源,通过导线与图1电解池相连.
(Ⅰ)X、Y为石墨,a为1L0.1mol/L的氯化钾溶液,写出电解总反应的离子方程式
(II)X、Y分别为铁、铜,a为1L0.1mol/L硫酸铜溶液,写出X电极反应式
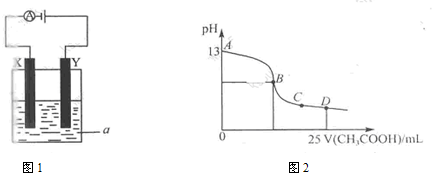
(3)室温时,按(I)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图2(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图2计算消耗标准状况下甲烷
②若图2的B点pH=7,则酸碱恰好完全反应的点是
③AB区间溶液中各离子浓度大小关系是
(1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池.写出其正极反应式
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(2)以上述电池为电源,通过导线与图1电解池相连.
(Ⅰ)X、Y为石墨,a为1L0.1mol/L的氯化钾溶液,写出电解总反应的离子方程式
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(II)X、Y分别为铁、铜,a为1L0.1mol/L硫酸铜溶液,写出X电极反应式
Cu2++2e-=Cu
Cu2++2e-=Cu
.
(3)室温时,按(I)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图2(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图2计算消耗标准状况下甲烷
280
280
mL.②若图2的B点pH=7,则酸碱恰好完全反应的点是
AB
AB
区间(填“AB”、“BC”或“CD”).③AB区间溶液中各离子浓度大小关系是
c(K+)>c(OH-)>c(CH3COO-)>c(H+)或c(K+)>c(CH3COO-)>c(OH-)>c(H+)或 c(K+)>c(CH3COO-)=c(OH-)>c(H+)
c(K+)>c(OH-)>c(CH3COO-)>c(H+)或c(K+)>c(CH3COO-)>c(OH-)>c(H+)或 c(K+)>c(CH3COO-)=c(OH-)>c(H+)
.分析:(1)燃料电池的正极发生得电子的还原反应;
(2)(Ⅰ)根据电解池的工作原理来书写电解方程式;
(Ⅱ)和电源的负极相连的是电解池的阴极,该极上是电解质的阳离子发生得电子的还原反应;
(3)①根据获得氢氧化钾的物质的量来确定转移电子的量,根据电子守恒来计算消耗标准状况下甲烷的体积;
②根据溶液显中性来确定酸碱恰好完全反应的点;
③根据AB区间溶液的组成情况来确定溶液中离子浓度的大小.
(2)(Ⅰ)根据电解池的工作原理来书写电解方程式;
(Ⅱ)和电源的负极相连的是电解池的阴极,该极上是电解质的阳离子发生得电子的还原反应;
(3)①根据获得氢氧化钾的物质的量来确定转移电子的量,根据电子守恒来计算消耗标准状况下甲烷的体积;
②根据溶液显中性来确定酸碱恰好完全反应的点;
③根据AB区间溶液的组成情况来确定溶液中离子浓度的大小.
解答:解:(1)燃料电池的正极是氧气发生得电子的还原反应,即O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(2)(Ⅰ)根据电解池的工作原理:阳极上是氯离子发生失电子的反应,阴极上是氢离子得电子的反应,总反应为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(Ⅱ)和电源的负极相连的是电解池的阴极,该极上是电解质的阳离子铜离子发生得电子的还原反应,
即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)①根据图示,开始溶液的PH为13,所以氢氧化钾的浓度是0.1mol/L,物质的量是0.1mol,根据电解方程式:
2Cl-+2H2O
Cl2↑+H2↑+2OH-,转移电子的物质的量是0.1mol,根据电子守恒,转移0.1mol电子消耗标准状况下甲烷的物质的量为0.0125mol,体积为280mL,故答案为:280;
②25mL0.1mol/L的氢氧化钠和0.2mol/L醋酸恰好完全反应时,消耗醋酸的体积是12.5mL,即B点的体积值是12.5mL,此时生成的醋酸钠溶液显碱性,当溶液显中性时,则醋酸的量应该大于12.5mL,所以酸碱恰好完全反应的点处于AB之间,故答案为:AB;
③AB区间的溶液可以是加入醋酸的量很少时的点,也可以是醋酸和氢氧化钠恰好完全反应的点,还可以是醋酸稍过量,溶液仍是碱性时的点,即c(K+)>c(OH-)>c(CH3COO-)>c(H+)(醋酸量很少)或c(K+)>c(CH3COO-)>c(OH-)>c(H+)(恰好反应)或 c(K+)>c(CH3COO-)=c(OH-)>c(H+)(溶液显中性的).
故答案为:c(K+)>c(OH-)>c(CH3COO-)>c(H+)或c(K+)>c(CH3COO-)>c(OH-)>c(H+)或 c(K+)>c(CH3COO-)=c(OH-)>c(H+).
(2)(Ⅰ)根据电解池的工作原理:阳极上是氯离子发生失电子的反应,阴极上是氢离子得电子的反应,总反应为:2Cl-+2H2O
| ||
| ||
(Ⅱ)和电源的负极相连的是电解池的阴极,该极上是电解质的阳离子铜离子发生得电子的还原反应,
即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)①根据图示,开始溶液的PH为13,所以氢氧化钾的浓度是0.1mol/L,物质的量是0.1mol,根据电解方程式:
2Cl-+2H2O
| ||
②25mL0.1mol/L的氢氧化钠和0.2mol/L醋酸恰好完全反应时,消耗醋酸的体积是12.5mL,即B点的体积值是12.5mL,此时生成的醋酸钠溶液显碱性,当溶液显中性时,则醋酸的量应该大于12.5mL,所以酸碱恰好完全反应的点处于AB之间,故答案为:AB;
③AB区间的溶液可以是加入醋酸的量很少时的点,也可以是醋酸和氢氧化钠恰好完全反应的点,还可以是醋酸稍过量,溶液仍是碱性时的点,即c(K+)>c(OH-)>c(CH3COO-)>c(H+)(醋酸量很少)或c(K+)>c(CH3COO-)>c(OH-)>c(H+)(恰好反应)或 c(K+)>c(CH3COO-)=c(OH-)>c(H+)(溶液显中性的).
故答案为:c(K+)>c(OH-)>c(CH3COO-)>c(H+)或c(K+)>c(CH3COO-)>c(OH-)>c(H+)或 c(K+)>c(CH3COO-)=c(OH-)>c(H+).
点评:本题既考查了原电池和电解池的工作原理又考查了溶液中酸和碱反应后离子浓度大小比较知识,综合性较强,难度大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目