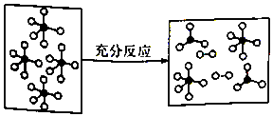
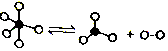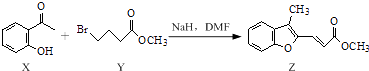题目内容
【题目】如图是工业海水提溴的部分流程,下列有关说法正确的是( ) 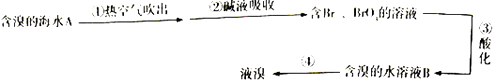
A.“吹出”采用热空气而不是常温空气的原因是热空气氧化性强
B.碱液吸收所发生的化学反应中氧化剂与还原剂之比为1:5
C.第③步中“酸化”要用强氧化性的酸,如硝酸
D.含溴的水溶液B中的单质溴浓度比A中的大
【答案】D
【解析】解:A.溴是易挥发的单质,利用热空气促使溴挥发得到溴蒸气,不是氧化性的作用,故A错误;B.溴单质在碱溶液中生成含Br﹣、BrO3﹣的混合溶液,溴元素化合价0价变化为﹣1价和+5价,据此计算氧化剂和还原剂物质的量之比5:1,故B错误;
C.酸化是发生反应5Br﹣+BrO3﹣+6H+=3Br2+3H2O,浓硝酸具有强氧化性和挥发性能直接氧化溴离子,溴元素不能全部转化,应用稀硫酸提供,故C错误;
D.分析可知,上述流程提取过程中溴单质反应后重新生成是富集溴,含溴的水溶液B中的单质溴浓度比A中的大,故D正确;
故选D.

练习册系列答案
相关题目