题目内容
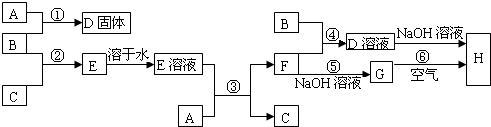
 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E溶液是无色的,F溶液是浅绿色的.请回答:
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按如图所示进行反应.又知E溶液是无色的,F溶液是浅绿色的.请回答:(1)试写出下列物质的化学式:A
(2)反应①的化学方程式:
(3)反应③的离子方程式:
(4)工业上经常利用B气体制取漂白粉,该反应的化学方程式为
(5)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol?L-1的D的水溶液,继续煮沸可制取一种红褐色胶体.
①生成红褐色胶体的方程式为
②证明有红褐色胶体生成的实验方法是
分析:B为黄绿色气体,应为Cl2,F溶液是浅绿色的,则F中含亚铁离子,则单质A应为Fe,由反应①可知D为FeCl3,由③可知,Fe与HCl反应生成FeCl2和H2,则E为HCl,C为H2,结合物质的相关性质解答该题.
解答:解:B为黄绿色气体,应为Cl2,F溶液是浅绿色的,则F中含亚铁离子,则单质A应为Fe,由反应①可知D为FeCl3,由③可知,Fe与HCl反应生成FeCl2和H2,则E为HCl,C为H2,
(1)由上述分析可知,A为Fe,B为Cl2,故答案为:Fe;Cl2;
(2)反应①为2Fe+3Cl2
2FeCl3,E为HCl,为强酸,电离方程式为HCl=H++Cl-,
故答案为:2Fe+3Cl2
2FeCl3;HCl=H++Cl-;
(3)反应③的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)B气体制取漂白粉,氯气与石灰乳反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)①D为FeCl3,在沸水中水解生成胶体,该反应为FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,故答案为:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl;
②丁达尔现象为胶体特有的性质,则利用丁达尔现象证明有红褐色胶体生成,故答案为:丁达尔现象.
(1)由上述分析可知,A为Fe,B为Cl2,故答案为:Fe;Cl2;
(2)反应①为2Fe+3Cl2
| ||
故答案为:2Fe+3Cl2
| ||
(3)反应③的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)B气体制取漂白粉,氯气与石灰乳反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)①D为FeCl3,在沸水中水解生成胶体,该反应为FeCl3+3H2O
| ||
| ||
②丁达尔现象为胶体特有的性质,则利用丁达尔现象证明有红褐色胶体生成,故答案为:丁达尔现象.
点评:本题考查无机物的推断,题目难度不大,本题注意根据物质的性质、特征作为突破口进行推断,侧重氯气及铁及其化合物之间转化的考查,学习中注意牢固把握元素化合物的性质,不要忽视物质的用途.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目