题目内容
实验室中部分仪器的图示为(图1)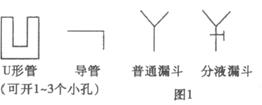
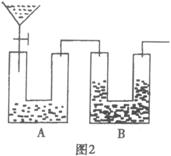
某同学用图2测定Na2CO3试样的纯度(杂质不与水反应),其中A容器中盛有Na2CO3样品10.0g,分液漏斗内盛有稀硫酸,B容器内为碱石灰固体。他利用碱石灰的增重求出纯净的Na2CO3质量,再求纯度。他重复正确操作了三次,结果数据出现了较大偏差(设原容器中CO2气体的含量可忽略不计,各容器内反应完全,下同)
(1)请你分析出现较大偏差的原因__________________________________________________。
通过仔细分析,该同学重新设计了一套实验装置(见图3)。(实验室中可供选择的试剂和药品还有Zn片、浓硫酸、NaOH溶液、CaCO3固体、蒸馏水)

(2)该同学新设计的装置仍不完整,应在_________处(填B或D)添加_________(写出装置及药品的名称)。
(3)A装置中分液漏斗所盛液体为_________,F装置在整套装置中的作用是_______________
_____________________________________________________________________。
(4)如果B、D内不设计任何装置而直接连通A、C、E,则实验结果将_________(填偏高、偏低、无影响)。
(1)①U形管A中的CO2气体未全部进入U形管B;②U形管A中的反应有少量的水蒸气进入U形管B
(2)D 盛浓H2SO4的洗气瓶
(3)稀H2SO4(或NaOH溶液) 防止空气中的CO2、H2O(g)进入E中
(4)偏高

氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示: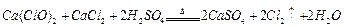 。某学习小组利用此原理设
。某学习小组利用此原理设 计如图所示装置制取氯气并探究其性质。
计如图所示装置制取氯气并探究其性质。
①在该实验中,甲部分的装置是 (填字母);指出a中m仪器的名称 。
|

 ②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填
②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填 加试剂的名称、至少填二种)方法 、
加试剂的名称、至少填二种)方法 、;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 ;
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入
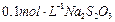 溶液:
溶液: ,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。 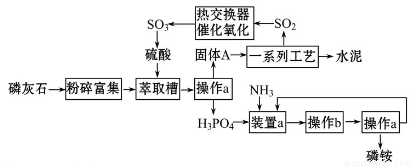
 。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。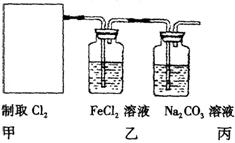


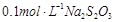 溶液:
溶液: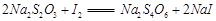 ,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。