题目内容
36g H2O与80g D2O的物质的量之比是_________,分子中所含质子数之比是________,所含中子数之比是________,它们分别与Na反应时,所放出气体体积之比(同条件下)是________,质量之比是________.
1:2 1:2 2:5 1:2 1:4
分析:根据n= =
= =
=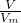 结合分子和原子的构成结合反应的方程式计算.
结合分子和原子的构成结合反应的方程式计算.
解答:n(H2O)=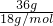 =2mol,n(D2O)=
=2mol,n(D2O)=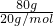 =4mol,
=4mol,
则:n(H2O):n(D2O)=2mol:4mol=1:2;
分子中所含质子数之比等于质子的物质的量之比为:2mol×10:4mol×10=1:2;
所含中子数之比等于中子的物质的量之比为:2mol×8:4mol×10=2:5;
它们分别与Na反应的方程式为:2Na+2H2O=2NaOH+H2↑,2Na+2D2O=2NaOD+D2↑,
则生成氢气的物质的量之比为1:2,体积之比为1:2,
质量之比为:1mol×2g/mol:2mol×4g/mol=1:4.
故答案为:1:2;1:2;2:5;1:2;1:4.
点评:本题考查物质的量的相关计算,题目难度不大,注意物质的组成和有关计算公式的运用.
分析:根据n=
 =
= =
=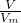 结合分子和原子的构成结合反应的方程式计算.
结合分子和原子的构成结合反应的方程式计算.解答:n(H2O)=
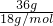 =2mol,n(D2O)=
=2mol,n(D2O)=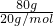 =4mol,
=4mol,则:n(H2O):n(D2O)=2mol:4mol=1:2;
分子中所含质子数之比等于质子的物质的量之比为:2mol×10:4mol×10=1:2;
所含中子数之比等于中子的物质的量之比为:2mol×8:4mol×10=2:5;
它们分别与Na反应的方程式为:2Na+2H2O=2NaOH+H2↑,2Na+2D2O=2NaOD+D2↑,
则生成氢气的物质的量之比为1:2,体积之比为1:2,
质量之比为:1mol×2g/mol:2mol×4g/mol=1:4.
故答案为:1:2;1:2;2:5;1:2;1:4.
点评:本题考查物质的量的相关计算,题目难度不大,注意物质的组成和有关计算公式的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目