题目内容
在标准状况下进行下列实验:甲、乙、丙各取300 mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
问:(1)盐酸的物质的量浓度是多少?
(2)求合金中镁、铝的质量分数。
(3)在丙实验之后,还需向容器中加入1.00 mol·L-1的NaOH溶液多少毫升才能使剩余合金中的铝全部溶解(设剩余合金与原合金成分相同)?
解析:(1)甲中盐酸过量,丙中合金过量
n(H2)=![]() =0.03 mol
=0.03 mol
c(HCl)=![]() =0.2 mol·L-1
=0.2 mol·L-1
(2)甲中盐酸过量,设甲中合金镁、铝的物质的量分别为x、y,有
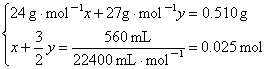
解得![]()
则w(Mg)=![]() ×100%=47.1%,
×100%=47.1%,
w(Al)=1-47.1%=52.9%。
(3)丙中含镁:![]() =0.018 mol,
=0.018 mol,
含铝:0.018 mol。
在整个反应过程中有氯元素守恒:HCl~NACl;Al守恒:Al~NaAlO2
共消耗NaOH:![]() +
+![]() =0.078 L=78 mL。
=0.078 L=78 mL。
答案:(1)0.2 mol·L-1
(2)w(Mg)=47.1% w(Al)=52.9%
(3)78 Ml

 天天向上口算本系列答案
天天向上口算本系列答案在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.390g | 0.702g | 0.936g |
| 气体体积 | 448mL | 672mL | 672mL |
分析上表数据后计算:
(1) 盐酸的物质的量浓度
(2)合金中镁与铝的物质的量之比
(3)在实验甲反应后溶液中加入过量 0.2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.390g | 0.702g | 0.936g |
| 气体体积 | 448mL | 672mL | 672mL |
(1)盐酸的物质的量浓度
(2)合金中镁与铝的物质的量之比
(3)在实验甲反应后溶液中加入过量 0.
 2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液? 在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量 |
0.390g |
0.702g |
0.936g |
|
气体体积 |
448mL |
672mL |
672mL |
分析上表数据后计算:
(1) 盐酸的物质的量浓度
(2)合金中镁与铝的物质的量之比
(3)在实验甲反应后溶液中加入过量 0.2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?