题目内容
已知化学反应2C(s)+O2(g) 2CO(g),2CO(g)+O2(g)
2CO(g),2CO(g)+O2(g) 2CO2(g)都是放热反应,据此判断,下列说法中不正确的是(其他条件相同)( )
2CO2(g)都是放热反应,据此判断,下列说法中不正确的是(其他条件相同)( )
A.12 g碳所具有的能量一定高于28 g CO所具有的能量
B.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
【答案】
A
【解析】
试题分析:对于放热反应,反应物的总能量一定高于生成物的总能量,C和CO的燃烧反应都是放热反应,C(s)+O2(g) CO2(g)必然是放热反应,12 g碳并不是反应物的全部。由于C
CO2(g)必然是放热反应,12 g碳并不是反应物的全部。由于C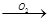 CO放热,CO
CO放热,CO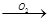 CO2放热,所以C
CO2放热,所以C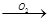 CO2比C
CO2比C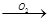 CO放出的热量要多,因此正确的答案选A。
CO放出的热量要多,因此正确的答案选A。
考点:考查反应热的有关计算和判断
点评:该题是基础性试题的考查,试题注重基础,兼顾能力的训练。该题的关键是明确反应是吸热还是放热与反应开始是否需要加热无关,而决定于反应物和反应产物所具有的总能量的相对大小,有助于培养学生的逻辑思维能力和灵活应变能力。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目