题目内容
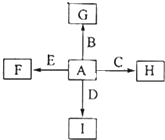
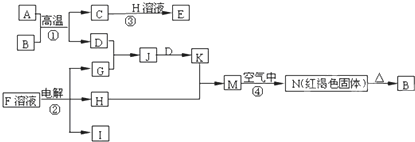
中学化学中几种常见物质的转化关系如图所示,A是常见金属单质,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围______;
(2)写出D的一种工业用途:______;
(3)①写出H2O2的电子式:______;
②写出B→G的化学方程式______;
③写出F转化为E的离子方程式______.

请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围______;
(2)写出D的一种工业用途:______;
(3)①写出H2O2的电子式:______;
②写出B→G的化学方程式______;
③写出F转化为E的离子方程式______.
已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体推断H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,A+B=C+D是金属置换铁的置换反应,判断为A为Al,B为Fe2O3,D为Al2O3,G为NaAlO2,
(1)胶体粒子直径介于1~100nm,故答案为:1~100nm;
(2)D为Al2O3,熔点高,可用与耐高温材料,还可用于冶炼铝,故答案为:耐火材料或电解法制金属铝;
(3)①H2O2的电子式为: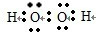 ,故答案为:
,故答案为: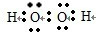 ;
;
②铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③氯化铁具有强氧化性,可与铁反应生成氯化亚铁,反应的方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
(1)胶体粒子直径介于1~100nm,故答案为:1~100nm;
(2)D为Al2O3,熔点高,可用与耐高温材料,还可用于冶炼铝,故答案为:耐火材料或电解法制金属铝;
(3)①H2O2的电子式为:
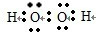 ,故答案为:
,故答案为: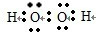 ;
;②铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③氯化铁具有强氧化性,可与铁反应生成氯化亚铁,反应的方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.

练习册系列答案
相关题目