题目内容
【题目】下面有关晶体的叙述中,不正确的是( )
A.金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻且距离相等的Cl-有8个
D.干冰晶体中,每个CO2分子周围紧邻且距离相等的CO2分子有12个
【答案】B
【解析】
A.金刚石的晶胞结构如图所示: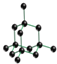 ,根据图可知由共价键形成的最小碳环上有6个碳原子,故A正确;
,根据图可知由共价键形成的最小碳环上有6个碳原子,故A正确;
B.氯化钠晶体中,钠离子在体心和棱心位置,氯离子在顶点和面心位置,1个钠离子与6个氯离子构成正八面体,所以每个钠离子与6个最近且等距离的氯离子以离子键结合,与每个氯离子最近的且等距离的氯离子有12个,故B错误;
C.氯化铯晶体晶胞结构如图: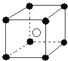 ,Cs+位于该晶胞的体心;而Cl-位于该晶胞的顶点,每个晶胞中含有一个铯离子,每个顶点上的氯离子被8个晶胞共用,每个氯离子周围最近的铯离子是8,故C正确;
,Cs+位于该晶胞的体心;而Cl-位于该晶胞的顶点,每个晶胞中含有一个铯离子,每个顶点上的氯离子被8个晶胞共用,每个氯离子周围最近的铯离子是8,故C正确;
D.二氧化碳晶体属于面心立方,采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数为12,所以在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子,故D正确;
答案选B。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是( )
A.升温不利于正反应生成Ni(CO)4(g)
B.在25 ℃时,反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v正>v逆
D.在80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子且互不重复)。
阳离子 | K+、Na+、Ba2+、NH |
阴离子 | CH3COO-、Cl-、OH-、SO |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D物质的焰色反应呈黄色;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是_______B的化学式_______
(2)写出C溶液和D溶液反应的化学方程式___________
(3)25 ℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是___(填A或C)。
(4) A溶液的pH大于7,用离子方程式表示原因______。





