题目内容
如图所示的试管中盛的是较浓的氨水,氨水中因加有酚酞而显浅红色。

(1)对试管以热水浴的方式加热,观察试管中的溶液,结果是___________(有现象就写明现象的内容,无现象就写明无现象的原因)。
(2)对加热后的试管放入约20 ℃的水中冷却,观察现象,试管中的溶液里有明显的现象,它是_______________________________。
(1)溶液的浅红色渐渐褪去 (2)溶液由无色逐渐变为浅红色
解析:
图中所示的实验装置是一个密闭的装置,在其中存在下列平衡状态:
NH3(aq)+H2O(l)![]() NH3·H2O(aq)
NH3·H2O(aq)![]()
![]() (aq)+OH-(aq)
(aq)+OH-(aq)
加热后NH3挥发,平衡向左移动,氨水中OH-浓度减小,氨水的碱性减弱;冷却后NH3又溶解,平衡向右移动,氨水中OH-浓度增大,溶液的碱性增强。

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
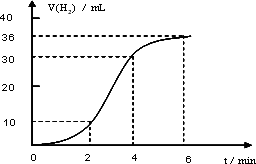
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管被水充满,原来试管中盛装的气体是( )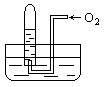
| A.肯定是NO2气体 | B.肯定是O2与NO2的混和气体 |
| C.肯定是NO气体 | D.可能是NO与NO2的混和气体 |