题目内容
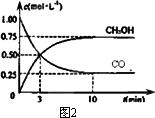
工业上用CO生产甲醇的反应为CO(g)+2H2(g)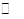 CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是
CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是

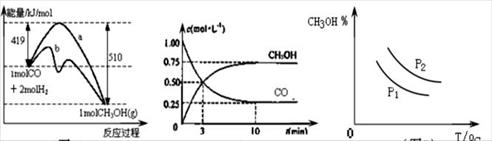
图10 图11 图12
A.CO和H2合成CH3OH的反应:△H<0,△S>0
B.保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小
C.图10中曲线b可表示使用了催化剂的能量变化情况
D.图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况
AB
【解析】
试题分析:A项:△S<0,故错;B项: 再充入1molCO和2molH2,化学平衡正向移动,n(CH3OH)/n(CO)增大,故错。故选AB。
考点:反应热 熵 化学平衡的移动
点评:本题考查较为综合,涉及反应热、熵、平衡移动以及电化学等知识,题目难度不大,注意把握影响平衡移动的因素以及平衡移动方向的判断。

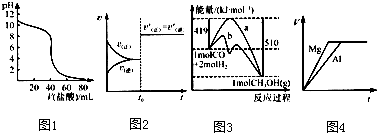
| A、图1表示盐酸滴加到0.1 mol?L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 | B、图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 | C、图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)?CH3OH(g),该反应的△H=-91 kJ?mol-1 | D、图4表示物质的量之比为2:3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系 |
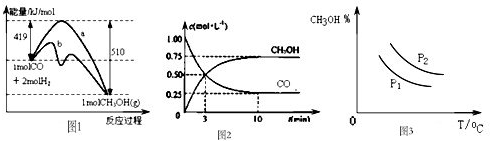
| A、CO和H2合成CH3OH的反应:△H<0,△S>0 | B、图1中曲线b可表示使用了催化剂的能量变化情况 | C、图3中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 | D、保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小 |
|
工业上用CO生产甲醇的反应为CO(g)+2H2(g)
| |
A. |
CO和H2合成CH3OH的反应:ΔH<0,ΔS>0. |
B. |
图1中曲线b可表示使用了催化剂的能量变化情况 |
C. |
图3中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
D. |
保持温度不变,再充入1 mol CO和2 mol H2,反应达到新平衡时n(CH3OH)/n(CO)减小 |
工业上用CO生产甲醇的反应为CO(g)+2H2(g) CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是
CH3OH(g)。图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图。下列叙述错误的是
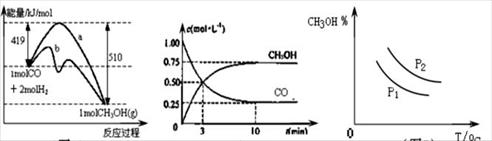
图10 图11 图12
| A.CO和H2合成CH3OH的反应:△H<0,△S>0 |
| B.保持温度不变,再充入1molCO和2molH2,反应达到新平衡时n(CH3OH)/n(CO)减小 |
| C.图10中曲线b可表示使用了催化剂的能量变化情况 |
| D.图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |