题目内容
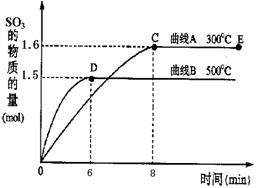
二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2 2SO3。 将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 条件下得到如上所示图象,回答下列问题:
条件下得到如上所示图象,回答下列问题:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ①300℃时,平衡常数K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
①300℃时,平衡常数K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
![]() ②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)= 。
②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)= 。
![]() ③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
![]() A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
![]() C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
![]()
![]()
![]()
①800 (2分) 减小(2分) ②0.0125mol?L-1?min-1 (2分) ③BC (2分)
![]()
![]()
![]()
![]()

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 二氧化硫是常用的化工原料,工业上常用它来制取硫酸.反应之一是:
二氧化硫是常用的化工原料,工业上常用它来制取硫酸.反应之一是:
 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题: 

