��Ŀ����
����Ŀ��̼Ԫ�صĵ����ж�����ʽ,��ͼ������C60��ʯī�ͽ��ʯ�Ľṹͼ:
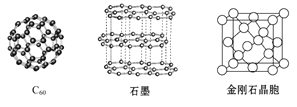
�ش���������:
(1)���ʯ��ʯī��C60��̼���ܵȶ���̼Ԫ�صĵ�����ʽ,���ǻ�Ϊ________��
(2)���ʯ��ʯīϩ(ָ����ʯī)��̼ԭ�ӵ��ӻ���ʽ�ֱ�Ϊ____��____��
(3)C60����____����,ʯī����____���塣
(4)ʯī������,����C��C���ļ���Ϊ142 pm,�����ʯ��C��C���ļ���Ϊ154 pm,��ԭ���ǽ��ʯ��ֻ����C��C��Ħҹ��ۼ�,��ʯī���ڵ�C��C�䲻������__���ۼ�,����____����
���ʯ��������____��̼ԭ�ӡ���̼ԭ�Ӱ뾶Ϊr,���ʯ�����ı߳�Ϊa,����Ӳ��Ӵ�ģ��,��r=____a,��ʽ��ʾ̼ԭ���ھ����еĿռ�ռ����____(��Ҫ�������)��
���𰸡� ͬ�������� sp3 sp2 ���� ��� �� ��(���л�p-p��) 8 ![]()
![]() =
=![]()
�����������⿼�龧�����㣬��1�����Ƕ���̼Ԫ����ɵĵ��ʣ���˻�Ϊͬ�������壻��2�����ʯ��C��4���������µ��Ӷԣ��ӻ�����Ϊsp3��ʯīϩ����3���Ҽ����µ��Ӷԣ��ӻ�����Ϊsp2����3��C60���ڷ��Ӿ��壬ʯī���ڻ�Ͼ��壻��4������ʯī�Ľṹ�����ڴ���̼̼֮���γɵĦҼ������֮���γɦм������ݽ��ʯ�����Ľṹ��̼ԭ�Ӹ���Ϊ8��1/8��6��1/2��4=8�����������̼ԭ�Ӿ�������Խ��ߵ�1/4�����������̼ԭ�Ӿ�����2r�������r= ![]() a���ռ�ռ������ԭ�ӵ�����뾧������ı�ֵ�����ʯ��������8��̼ԭ�ӣ������Ϊ
a���ռ�ռ������ԭ�ӵ�����뾧������ı�ֵ�����ʯ��������8��̼ԭ�ӣ������Ϊ![]() �����������Ϊa3����˿ռ�ռ����Ϊ
�����������Ϊa3����˿ռ�ռ����Ϊ![]() =
=![]() ��
��

����Ŀ��Ϊȷ��Na2CO3��NaHCO3�������Ʒ���������ȡ�ķݸ���Ʒ����ˮ��ֱ���μ�����ͬŨ������30.0 mL����ַ�Ӧ������CO2�����(������ɱ�״���µ������������CO2��ˮ�е��ܽ�)���±���
ʵ����� | �� | �� | �� | �� |
�������(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
��Ʒ����(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2���(mL) | 672 | 840 | 896 | 672 |
(1)��Ʒ�е����ʵ���֮��n(Na2CO3)��n(NaHCO3)��________��
(2)��������ʵ���Ũ��c(HCl)��________��


