题目内容
19. 在10L的密闭容器中,A、B、C 三种物质的物质的量(n)与时间(t)的关系如图一所示,C的百分含量(C%)与温度(T)的关系如图二所示,下列分析错误的是( )
在10L的密闭容器中,A、B、C 三种物质的物质的量(n)与时间(t)的关系如图一所示,C的百分含量(C%)与温度(T)的关系如图二所示,下列分析错误的是( )| A. | 该反应的化学方程式是2A+B?C | |
| B. | 0~4 min时,A的平均反应速率为0.1 mol/(L•min) | |
| C. | 由T1向T2变化时,v(正)>v(逆) | |
| D. | 平衡后升高温度,反应的平衡常数K值减小 |
分析 A.由图可知,A、B的物质的量减少,为反应物,C的物质的量增大,C为生成物,A、B、C的△n之比为(2.4-1.6):(1.6-1.2):(0.4-0)=2:1:1,一段时间后达到平衡状态;
B.0~4 min时,A的物质的量减少2.4mol-2.0mol=0.4mol,结合v=$\frac{△c}{△t}$计算;
C.图二中,由T1向T2变化时,平衡正向移动;
D.由图二中最高点可知,升高温度,C%减小,可知升高温度平衡逆向移动,正反应为放热反应.
解答 解:A.由图可知,A、B的物质的量减少,为反应物,C的物质的量增大,C为生成物,A、B、C的△n之比为(2.4-1.6):(1.6-1.2):(0.4-0)=2:1:1,一段时间后达到平衡状态,转化的物质的量比等于化学计量数之比,则反应为2A+B?C,故A正确;
B.0~4 min时,A的物质的量减少2.4mol-2.0mol=0.4mol,0~4 min时,A的平均反应速率为$\frac{\frac{0.4mol}{10L}}{4min}$=0.01 mol/(L•min),故B错误;
C.图二中,由T1向T2变化时,平衡正向移动,则v(正)>v(逆),故C正确;
D.由图二中最高点可知,升高温度,C%减小,可知升高温度平衡逆向移动,正反应为放热反应,则升高温度,平衡常数K值减小,故D正确;
故选B.
点评 本题考查物质的量随时间的变化曲线,为高频考点,把握图中物质的量的变化、温度对平衡的影响、速率计算为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
9.硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,下列说法错误的是( )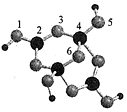

| A. | 在Xm-中,硼原子轨道的杂化类型有sp2、sp3 | |
| B. | 配位键存在于4、5原子之间 | |
| C. | m=3 | |
| D. | 硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有共价键、范德华力、氢键 |
10.根据元素周期表的知识推测原子序数为115的元素,下列对它的叙述正确的是( )
①位于第7周期
②非金属元素
③最外电子层有5个电子
④没有放射性
⑤属于氮族元素
⑥属于锕系元素.
①位于第7周期
②非金属元素
③最外电子层有5个电子
④没有放射性
⑤属于氮族元素
⑥属于锕系元素.
| A. | ①③⑤ | B. | ②④⑥ | C. | ①③⑥ | D. | ③④⑤ |
7.下列关于锌铜原电池的说法中正确的是( )


| A. | 电流由锌片流到铜片 | |
| B. | 铜片上产生大量气泡并且铜片不断减少 | |
| C. | 锌片上发生失电子的还原反应 | |
| D. | 这是一个将化学能转变为电能的装置 |
11.下列有关电池的说法不正确的是( )
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 燃料电池可将热能直接转变为电能 | |
| C. | 较长时间不使用电器时,最好从电器中取出电池,并妥善存放 | |
| D. | 铅蓄电池放电时,负极是Pb,正极是PbO2 |
8.有关硝酸化学性质的叙述中,正确的是( )
| A. | 浓、稀硝酸都能使蓝色石蕊试纸变红色 | |
| B. | 硝酸能与Na2CO3反应,但不生成CO2 | |
| C. | 硝酸可与Na2S反应制得H2S气体 | |
| D. | 浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色 |
 25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图 (忽略溶液体积的变化、H2S的挥发).
25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图 (忽略溶液体积的变化、H2S的挥发). 依据氧化还原反应:
依据氧化还原反应: