题目内容
【题目】我国利用合成气直接制烯烃获重大突破,其原理是
反应①:C(s)+1/2O2(g)=CO(g) ΔH1
反应②:C(s)+H2O(g)=CO(g)+H2(g) ΔH2
反应③:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.1 kJ·mol-1
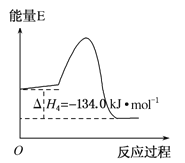
反应④:2CH3OH(g)→CH3OCH3(g)+H2O(g) ΔH4,能量变化如图所示
反应⑤:3CH3OH(g)→CH3CH=CH2(g)+3H2O(g) ΔH5=-31.0 kJ·mol-1
下列说法正确的是( )
A. 反应③使用催化剂,ΔH3减小 B. ΔH1-ΔH2<0
C. 反应④中正反应的活化能大于逆反应的活化能 D. 3CO(g)+6H2(g)→CH3CH=CH2(g)+3H2O(g) ΔH=-121.1 kJ·mol-1
【答案】B
【解析】A.催化剂不改变反应的始终态;B. ①-②得到H2(g)+1/2O2(g)= H2O(g),氢气燃烧放出热量;C.④为放热反应,焓变为正逆反应的活化能之差;D. ③×3+⑤得到得到3CO(g)+6H2(g)→CH3CH=CH2(g)+3H2O(g),根据盖斯定律计算ΔH。
催化剂不改变反应的始终态,则反应③使用催化剂, ΔH3不变,A错误;根据盖斯定律:①-②得到H2(g)+ 1/2O2(g)= H2O(g),,氢气燃烧放出热量,则ΔH1-ΔH2<0, B正确;④为放热反应,焓变为正逆反应的活化能之差,则反应④中正反应的活化能小于逆反应的活化能, C错误;根据盖斯定律:③×3+⑤得到3CO(g)+6H2(g)→CH3CH=CH2(g)+3H2O(g) ΔH=(-90.1×3-31=-301.3 kJ·mol-1,D错误;正确选项B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目