题目内容
【题目】在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)![]() 2C(g)+D(s)
2C(g)+D(s)
△H=a kJ/mol实验内容和结果分别如下表和右图所示。下列说法正确的是
实验 序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
Ⅱ | 800℃ | 1.5mol | 0.5mol | - |
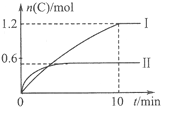
A. 实验Ⅰ中,10min内平均速率v(B)=0.06mol/(L·min);
B. 上述方程式中a=-160
C. 600℃时,该反应的平衡常数是1.5
D. 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率减小
【答案】BC
【解析】
A、图象分析可知实验Ⅰ中,10 min内C生成了1.2mol,结合化学反应速率v=△c/△t计算,速率之比等于化学方程式计量数之比,以此计算B的反应速率;
B、根据图象中的变化量结合图表中热量变化计算,依据化学平衡三段式可知,
A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ/mol,
2C(g)+D(s) △H=a kJ/mol,
起始量(mol) 1 3 0 0
变化量(mol) 0.6 0.6 1.2 0.6 96kJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化;
C、结合B中化学平衡三段式列式计算平衡浓度,c(A)=0.2mol·L-1,c(B)=1.2mol·L-1,c(C)=0.6mol·L-1,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D、反根据等效平衡分析判断,反应前后气体体积不变,等比等效分析.
A、.10 min内C生成了1.2mol,则反应速率v(C)=1.2mol/(2L×10min)==0.06mol·L-1·min-1,速率之比等于化学方程式计量数之比,v(B)=1/2 v(C)=0.06mol·L-1·min-1×1/2=0.03mol·L-1·min-1,故A 错误;
B、根据图象中的变化量结合图表中热量变化计算,依据化学平衡三段式可知,
A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ/mol,
2C(g)+D(s) △H=a kJ/mol,
起始量(mol) 1 3 0 0
变化量(mol) 0.6 0.6 1.2 0.6 96kJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化,则a=96kJ/0.6mol=160kJ·mol-1,图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,所以a=-160kJ·mol-1。故B正确;
C、由B中可知平衡浓度:c(A)=0.2mol·L-1,c(B)=1.2mol·L-1,c(C)=0.6mol·L-1,平衡常数K=0.62/0.2×1.2=1.5,故C正确;
、反应前后气体体积不变,等比等效,开始投入量 A与B的物质的量之比为3:1,向实验Ⅱ的平衡体系中再充0.5 mol A和1.5 mol B,可以看作先投入0.5 mol A和0.5/3 mol B,两个平衡为等效平衡,再把剩余的B加入。增大B的浓度使平衡向正反应方向移动,则A的转化率增大,故D错误;
故选BC。