题目内容
A、B为两种单质,常温下均是固体。在元素周期表中A、B为前18号元素中的两种。分别取三份质量为1.52 g的A、B的混合物(粉末)进行如下实验。(本题中所有的气体体积均指标准状况下的体积)
(a)向第一份试样中加入过量的盐酸,充分反应后放出0.896 L气体,还余下0.56 g残渣;
(b)向第二份试样中加入过量的10%的NaOH溶液,充分反应后放出0.896 L气体,还余下0.96 g残渣;?
(c)将第三份试样隔绝空气加强热后,生成一种固体,冷却后再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质A是__________。
(2)混合物中的B的质量分数是__________。
(3)写出实验(c)中有关反应的化学方程式并计算x的值。
(a)向第一份试样中加入过量的盐酸,充分反应后放出0.896 L气体,还余下0.56 g残渣;
(b)向第二份试样中加入过量的10%的NaOH溶液,充分反应后放出0.896 L气体,还余下0.96 g残渣;?
(c)将第三份试样隔绝空气加强热后,生成一种固体,冷却后再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质A是__________。
(2)混合物中的B的质量分数是__________。
(3)写出实验(c)中有关反应的化学方程式并计算x的值。
(1)Mg(镁) (2)36.8% (3)2Mg+Si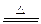 Mg2Si Mg2Si+4HCl=2MgCl2+SiH4↑ x=0.448
Mg2Si Mg2Si+4HCl=2MgCl2+SiH4↑ x=0.448
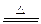 Mg2Si Mg2Si+4HCl=2MgCl2+SiH4↑ x=0.448
Mg2Si Mg2Si+4HCl=2MgCl2+SiH4↑ x=0.448(1)设A的摩尔质量为MA,化合价为nA,则由(a)根据电子守恒得: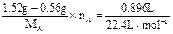 ×2
×2 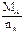 =12 g·mol-1
=12 g·mol-1
讨论可得:nA=2,MA=24 g·mol-1应为Mg
(3)由(b)设B的摩尔质量为MB,化合价为nB,则有: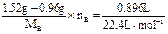 ×2
×2
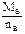 =7 g·mol-1,由于A、B同周期且原子半径A>B,只有nB=4,MB=28 g·mol-1,B为硅.由题意知n(Mg)∶n(Si)=2∶1,恰好完全反应,则Si~Mg2Si~SiH4↑
=7 g·mol-1,由于A、B同周期且原子半径A>B,只有nB=4,MB=28 g·mol-1,B为硅.由题意知n(Mg)∶n(Si)=2∶1,恰好完全反应,则Si~Mg2Si~SiH4↑ 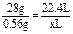
x=0.448?
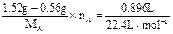 ×2
×2 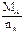 =12 g·mol-1
=12 g·mol-1讨论可得:nA=2,MA=24 g·mol-1应为Mg
(3)由(b)设B的摩尔质量为MB,化合价为nB,则有:
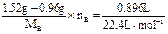 ×2
×2 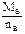 =7 g·mol-1,由于A、B同周期且原子半径A>B,只有nB=4,MB=28 g·mol-1,B为硅.由题意知n(Mg)∶n(Si)=2∶1,恰好完全反应,则Si~Mg2Si~SiH4↑
=7 g·mol-1,由于A、B同周期且原子半径A>B,只有nB=4,MB=28 g·mol-1,B为硅.由题意知n(Mg)∶n(Si)=2∶1,恰好完全反应,则Si~Mg2Si~SiH4↑ 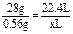
x=0.448?

练习册系列答案
相关题目