题目内容
实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
|
CaCl2 |
MgCl2 |
CaSO4 |
|
36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/cm3)。
② 精制食盐水(粗食盐中含有少量Ca2+、Mg2+、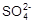 等杂质)用盐酸将滤液的pH值调至7。
等杂质)用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是______________________;
(2)步骤②中,SO42-是否需要除去?_________,理由是________________
(3)步骤④中所有操作的共同目的是_____________;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是____________,在通常情况下,检验这种阳离子的方法_______________________。
(1)用玻璃棒搅拌(1分)
(2)不需要(1分);除去Ca2+、Mg2+后, 在溶液所控制的温度下,可能存在的硫酸盐的溶解度比NaHCO3大,且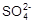 含量少,过滤后会留在母液中(1分)
含量少,过滤后会留在母液中(1分)
(3)使生成NaHCO3的反应充分进行(1分)
(4)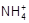 (1分);取少量待检物放入试管里,滴入少量NaOH溶液,加热(1分),将润湿的红色石蕊试纸放在管口(或蘸有浓盐酸的玻璃棒靠近管口),观察试纸是否变蓝(或是否出现白烟)(1分)
(1分);取少量待检物放入试管里,滴入少量NaOH溶液,加热(1分),将润湿的红色石蕊试纸放在管口(或蘸有浓盐酸的玻璃棒靠近管口),观察试纸是否变蓝(或是否出现白烟)(1分)
【解析】
试题分析:(1)由于是配制50 mL约25%的粗食盐水溶液,所以步骤①中,配制溶液的最后一步操作是用玻璃棒搅拌。
(2)由于除去Ca2+、Mg2+后, 在溶液所控制的温度下,可能存在的硫酸盐的溶解度比NaHCO3大,且SO42-含量少,过滤后会留在母液中,所以不必要除去。
(3)实验的目的就是制备纯碱,而纯碱的制备是通过碳酸氢钠热分解生产的,所以步骤④中所有操作的共同目的是使生成NaHCO3的反应充分进行。
(4)溶液中的阳离子主要是NH4+,所以步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是NH4+,检验NH4+的方法是取少量待检物放入试管里,滴入少量NaOH溶液,加热(1分),将润湿的红色石蕊试纸放在管口(或蘸有浓盐酸的玻璃棒靠近管口),观察试纸是否变蓝(或是否出现白烟)。
考点:考查质量分数的配制、分离和提纯、实验操作以及离子的检验
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生实验能力的培养和训练,有利于培养学生的逻辑推理能力和规范、严谨的实验设计和操作能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
| |||||||||||||||||||
(8分)实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
| NaCl | NH4HCO3 | NaHCO3 | NH4Cl | Na2SO4 | (NH4)2SO4 | CaCl2 | MgCl2 | CaSO4 |
| 36.3 | 27.0 | 11.1 | 41.4 | 40.8 | 78 | 51.7 | 26.2 | 0.165 |
①配制50 mL约25%的粗食盐水溶液(密度近似为1 g/mL)。
②精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO42-等杂质),用盐酸将滤液的pH值调至7。
③加热食盐水,将溶液温度控制在30 ─ 35℃。
④在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、搅拌半小时。
⑤静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是 ;
(2)步骤②中,SO42-是否需要加入某种试剂除去? ,理由是
(3)步骤④中所有操作的共同目的是 ;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是 ,在通常情况下,检验这种阳离子的实验操作为 。
(8分)实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
(NH4)2SO4 |
CaCl2 |
MgCl2 |
CaSO4 |
|
36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/mL)。
② 精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO42-等杂质),用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是 ;
(2)步骤②中,SO42-是否需要加入某种试剂除去? ,理由是
(3)步骤④中所有操作的共同目的是 ;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是 ,在通常情况下,检验这种阳离子的实验操作为 。
