题目内容
南通濒江临海,有较长的海岸线,海洋资源十分丰富.
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、
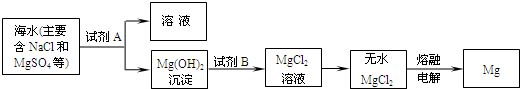
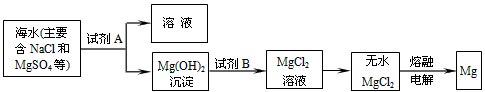
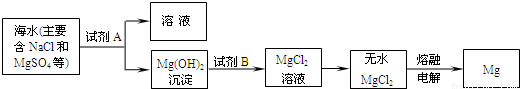
(2)目前世界上60%的镁是从海水中提取的.其主要步骤如下:
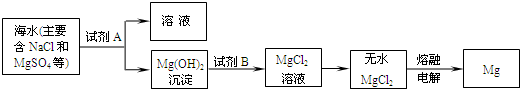
①提取Mg的过程中,试剂A可以选用
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去
(3)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、
过滤
过滤
、蒸发
蒸发
可制得精盐.(2)目前世界上60%的镁是从海水中提取的.其主要步骤如下:

①提取Mg的过程中,试剂A可以选用
氢氧化钙溶液
氢氧化钙溶液
,试剂B选用盐酸
盐酸
,由无水MgCl2制取Mg的反应类型为分解反应
分解反应
.②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去
Na2SO4
Na2SO4
;加入过量Na2CO3溶液的目的是除去CaCl2和过量的BaCl2
除去CaCl2和过量的BaCl2
.(3)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是
取样并滴加AgNO3溶液,若没有白色沉淀,说明蒸馏海水为淡水
取样并滴加AgNO3溶液,若没有白色沉淀,说明蒸馏海水为淡水
.分析:(1)根据粗盐提纯的主要步骤是:溶解、过滤、蒸发;
(2)①可根据MgSO4转化为Mg(OH)2的关系分析;可根据Mg(OH)2转化为MgCl2的关系分析;可根据化学方程式来判断;
②除去硫酸根离子常用钡离子;Na2CO3可以把过量的钡离子转化为沉淀,同时能够和钙离子结合生成沉淀;
(3)检验水中是否含有氯离子;
(2)①可根据MgSO4转化为Mg(OH)2的关系分析;可根据Mg(OH)2转化为MgCl2的关系分析;可根据化学方程式来判断;
②除去硫酸根离子常用钡离子;Na2CO3可以把过量的钡离子转化为沉淀,同时能够和钙离子结合生成沉淀;
(3)检验水中是否含有氯离子;
解答:解:(1)粗盐提纯的主要步骤是:溶解、过滤、蒸发,故答案为:过滤;蒸发;
(2)①MgSO4与Ca(OH)2反应:MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4,Mg(OH)2与HCl反应:Mg(OH)2+2HCl=MgCl2+H2O,无水MgCl2制取Mg的反应:MgCl2(熔融)
Mg+Cl2↑,是分解反应,
故答案为:氢氧化钙溶液;盐酸;分解反应;
②钡离子可以和硫酸根反应生成沉淀,碳酸根离子可以把过量的钡离子转化为沉淀,同时能够和钙离子结合生成沉淀,
故答案为:Na2SO4;除去CaCl2和过量的BaCl2;
(3)检验氯离子的方法:取样并滴加AgNO3溶液,若没有白色沉淀,说明无氯离子,证明蒸馏得到的水为淡水即证明水中无氯离子,故答案为:取样并滴加AgNO3溶液,若没有白色沉淀,说明蒸馏海水为淡水.
(2)①MgSO4与Ca(OH)2反应:MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4,Mg(OH)2与HCl反应:Mg(OH)2+2HCl=MgCl2+H2O,无水MgCl2制取Mg的反应:MgCl2(熔融)
| ||
故答案为:氢氧化钙溶液;盐酸;分解反应;
②钡离子可以和硫酸根反应生成沉淀,碳酸根离子可以把过量的钡离子转化为沉淀,同时能够和钙离子结合生成沉淀,
故答案为:Na2SO4;除去CaCl2和过量的BaCl2;
(3)检验氯离子的方法:取样并滴加AgNO3溶液,若没有白色沉淀,说明无氯离子,证明蒸馏得到的水为淡水即证明水中无氯离子,故答案为:取样并滴加AgNO3溶液,若没有白色沉淀,说明蒸馏海水为淡水.
点评:本题考查了粗盐提纯的步骤,解答时要掌握物质之间的转化和相关知识,才能做出正确解答,做此类框图题时要注意所加其它试剂是否过量,若过量要考虑是否需要除去.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目