题目内容
【题目】最近几年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如1图所示.据此判断:
2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如1图所示.据此判断: 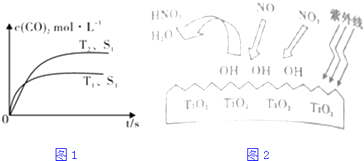
①该反应的△H0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线 .
③研究表明在紫外线照射下,由于TiO2的催化作用,空气中的某些物质会产生OH自由基,如图2所示,OH与NO2反应为NO2+OH=HNO3 , 写出NO与OH反应的化学方程式
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)N2O4(g)△H=﹣56.9kJ/mol
H2O(g)=H2O(l)△H=﹣44kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
②将煤燃烧产生的二氧化碳回收利用,可达到低碳排放的目的.NH3与CO2在120℃,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)(NH2)2CO(s)+H2O(g).现将物质的量为1:1的NH3与CO2混合在密闭固体容器中反应,平衡后,NH3的体积分数为20%,则NH3的平衡转化率为 .
③25℃时,将amolL﹣1的氨水与b molL﹣1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3H2O的电离平衡常数为 .
【答案】
(1)<; ;NO+3OH═HNO3+H2O
;NO+3OH═HNO3+H2O
(2)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=﹣898.1kJ/mol;75%;![]()
【解析】解:(1)①由图可知,温度T1先到达平衡,故温度T1>T2 , 温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,所以答案是:<;②若催化剂的表面积S1>S2 , 由增大其表面积可提高化学反应速率,故T2、S2条件下到达平衡时间比T2、S1的时间更长,但不影响化学平衡移动,平衡时二氧化碳的浓度不变,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线为:  ;
;
所以答案是:  ;③由图象可知NO、NO2均被OH氧化为HNO3,由原子守恒,NO+3OH═HNO3+H2O;所以答案是:NO+3OH═HNO3+H2O;(2)①已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
;③由图象可知NO、NO2均被OH氧化为HNO3,由原子守恒,NO+3OH═HNO3+H2O;所以答案是:NO+3OH═HNO3+H2O;(2)①已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
②2NO2(g)N2O4(g)△H=﹣56.9kJ/mol
③H2O(g)=H2O(l)△H=﹣44kJ/mol
根据盖斯定律:①﹣②+③×2可得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=﹣898.1kJ/mol;
所以答案是:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),△H=﹣898.1kJ/mol;②NH3与CO2物质的量为1:1,设起始量均为1 mol,NH3的平衡转化率为x,根据三段式:
CO2(g)+ | 2NH3(g) | (NH2)2CO(s)+ | H2O(g) | ||
起始量(mol): | 1 | 1 | 0 | 0 | |
转化量(mol): | 0.5x | x | 0.5x | 0.5x | |
平衡量(mol): | 1﹣0.5x | 1﹣x | 0.5x | 0.5x |
NH3的体积分数为20%,则有 ![]() =20%,解得x=75%;
=20%,解得x=75%;
所以答案是:75%;③根据电荷守恒有c(NH4+)+c(H+)=c(Cl﹣)+c(OH﹣),由于溶液呈中性,则c(H+)=c(OH﹣)10﹣7mol/L,故c(NH4+)=c(Cl﹣)= ![]() ×bmolL﹣1=0.5bmolL﹣1 , 故混合后溶液中c(NH3 . H2O)=
×bmolL﹣1=0.5bmolL﹣1 , 故混合后溶液中c(NH3 . H2O)= ![]() ×amolL﹣1﹣0.5bmolL﹣1=(0.5a﹣0.5b)mol/L,NH3H2O的电离常数Kb=
×amolL﹣1﹣0.5bmolL﹣1=(0.5a﹣0.5b)mol/L,NH3H2O的电离常数Kb= ![]() =
= ![]() =
= ![]() ;
;
所以答案是: ![]() .
.
【考点精析】掌握反应热和焓变和化学平衡的计算是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案