题目内容
(11分)有关物质的量的计算。
(1)有NaCl、CaCl2、AlCl3三种溶液,若溶质的物质的量相等,分别与足量的硝酸银溶液反应,则生成沉淀的物质的量之比为________________.若生成的沉淀的质量相等,则三种溶液中溶质的物质的量之比为__________。
(2)相同质量的SO2和SO3,所含分子的数目之比为_________;所含O的物质的量之比为________。
(3)下列各物质所含原子数目,按由大到小顺序排列的是
①0.5mol NH3 ②标准状况下22.4L He ③4℃9mL水 ④0.2mol H3PO4
(1)有NaCl、CaCl2、AlCl3三种溶液,若溶质的物质的量相等,分别与足量的硝酸银溶液反应,则生成沉淀的物质的量之比为________________.若生成的沉淀的质量相等,则三种溶液中溶质的物质的量之比为__________。
(2)相同质量的SO2和SO3,所含分子的数目之比为_________;所含O的物质的量之比为________。
(3)下列各物质所含原子数目,按由大到小顺序排列的是
①0.5mol NH3 ②标准状况下22.4L He ③4℃9mL水 ④0.2mol H3PO4
(1)1:2:3(2分);6:3:2(2分)
(2)5:4 (2分) 5:6(2分)
(3)①④③②(3分)
(2)5:4 (2分) 5:6(2分)
(3)①④③②(3分)
试题分析:(1)等物质的量的NaCl、CaCl2、AlCl3三种溶液中Cl-的量之比为1:2:3,因此产生AgCl沉淀的物质的量之比为1:2:3 。若生成的沉淀的质量相等,则其物质的量也相等,故所需的Cl-的量也相等,因此三种溶液的溶质的物质的量之比为3:2:1 。
(2)设SO2和SO3的质量为m,则其物质的量分别为:
 。因此所含分子数之比为:
。因此所含分子数之比为: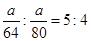 ;所含O的物质的量之比为:
;所含O的物质的量之比为: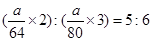 。
。(3)①所含的原子数为
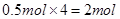 ;②所含的原子数为
;②所含的原子数为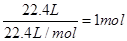 ;③所含的原子数为
;③所含的原子数为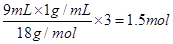 ;④所含的原子数为
;④所含的原子数为 ;因此所含的原子数大小关系为①>④>③>②
;因此所含的原子数大小关系为①>④>③>②点评:本题属于基础题,也是高考常考内容。只需掌握常见的计算公式,即可很好的解答此题。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目