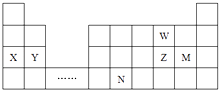
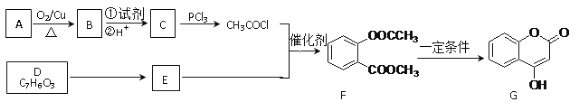
题目内容
【题目】卤代烃与金属镁在无水乙醚中反应,可得格氏试剂R—MgX,它可与醛、酮等羰基化合物加成:![]() ,得产物经水解可以得到醇,这是某些复杂醇的合成方法之一,现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是
,得产物经水解可以得到醇,这是某些复杂醇的合成方法之一,现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是
A. 乙醛和氯乙烷 B. 甲醛和1-溴丙烷
C. 丙酮和一氯甲烷 D. 甲醛和2-溴丙烷
【答案】C
【解析】由信息:![]() 可知,此反应原理为断开C=O双键,烃基加在碳原子上,MgX加在O原子上,产物水解得到醇,发生取代反应,即氢原子(H)取代MgX,现要制取(CH3)3COH,即若合成2甲基2丙醇,则反应物中碳原子数之和为4。
可知,此反应原理为断开C=O双键,烃基加在碳原子上,MgX加在O原子上,产物水解得到醇,发生取代反应,即氢原子(H)取代MgX,现要制取(CH3)3COH,即若合成2甲基2丙醇,则反应物中碳原子数之和为4。
A. 氯乙烷和乙醛反应,生成的产物经水解,得到CH3CH(OH)CH2CH3,故A错误;
B. 甲醛和1-溴丙烷反应,生成的产物经水解,得到丁醇(CH3CH2CH2CH2OH),故B错误;
C. 丙酮和一氯甲烷反应生成产物为2甲基2丙醇,故C正确;
D. 甲醛和2-溴丙烷,反应生成产物经水解得到2甲基1丙醇,不是2甲基2丙醇,故D错误;
故答案选C。

【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。

(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。