题目内容
【题目】Ⅰ.由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。欲测定某样品中NaNO2的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液V mL。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外还有____________。
(2)在进行滴定操作时,KMnO4溶液盛装在______(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,____________________________时达到滴定终点。
(3)滴定过程中发生反应的离子方程式是_________________;测得该样品中NaNO2的质量分数为___________。
(4)以下操作造成测定结果偏高的是__________。
A.滴定管未用KMnO4标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
Ⅱ.(5)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() =____。(结果保留两位有效数字)(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
=____。(结果保留两位有效数字)(已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17)
(6)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=________mol/L;将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的![]() =________。
=________。
【答案】100mL容量瓶 酸式 溶液由无色变为浅紫色,且半分钟不褪色 2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O ![]() AC 4.7×10-7 6×10-3 0.62
AC 4.7×10-7 6×10-3 0.62
【解析】
I. (1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)依据高锰酸钾具有强的氧化性,结合酸式滴定管、碱式滴定管构造特点及使用对象选择滴定管;高锰酸钾本身为紫色溶液,当NaNO2反应时被还原为无色的Mn2+,根据溶液颜色变化判断;
(3) NaNO2与酸性KMnO4溶液发生氧化还原反应,NO2-被氧化生成NO3-,MnO4-被还原生成Mn2+,结合电子守恒、电荷守恒及原子守恒书写反应方程式;根据该方程式中NO2-,MnO4-的物质的量的比,利用n(MnO4-)计算出25mL溶液中n(NO2-)及m(NO2-),就可得到NaNO2的含量;
(4)依据c=![]() ,结合方程式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O中NO2-与MnO4-的关系,分析操作对消耗标准液体积影响进行误差分析;
,结合方程式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O中NO2-与MnO4-的关系,分析操作对消耗标准液体积影响进行误差分析;
II. (5)AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,根据溶液中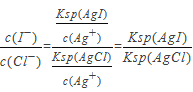 计算;
计算;
(6)根据电离平衡常数计算离子浓度;结合H2SO3的第二步电离平衡常数表达式,利用溶液中c(H+)=c(OH-)=1.0×10-7mol/L计算。
I.(1)据配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制成100 mL溶液应选择100mL容量瓶,所以还缺少的仪器是100mL容量瓶;
(2)高锰酸钾溶液具有强的氧化性,若用碱式滴定管能够会腐蚀橡皮管,所以应选择酸式滴定管盛放;高锰酸钾本身为紫色溶液,当与NaNO2反应时被还原为无色的Mn2+,因此当滴入最后一滴高锰酸钾酸性溶液时,锥形瓶中液体由无色溶液变成粉红色,且30s内不褪色则可以判断达到滴定终点;
(3) NaNO2与酸性KMnO4溶液发生氧化还原反应,NO2-被氧化生成NO3-,MnO4-被还原生成Mn2+,结合电子守恒、电荷守恒及原子守恒可得反应的离子方程式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;n(MnO4-)=cV=0.0200mol/L×VmL×10-3L/mL=2V×10-5mol,则根据方程式中物质简单关系可知在25mL溶液中含n(NO2-)=![]() n(MnO4-)=
n(MnO4-)=![]() ×2V×10-5mol=5V×10-5mol,所以该样品中NaNO2的质量分数为=
×2V×10-5mol=5V×10-5mol,所以该样品中NaNO2的质量分数为=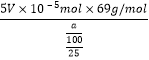 ×100%=
×100%=![]() 。
。
(4) A.滴定管未用KMnO4标准溶液润洗,c(标)偏低,则消耗V(标)偏大,根据c=![]() 可知所求待测液的浓度偏高,A正确;
可知所求待测液的浓度偏高,A正确;
B.锥形瓶未用待测液润洗,由于待测溶质的物质的量不变,所以对待测溶液的浓度无影响,B错误;
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失,则V(标)偏大,n(标)偏大,根据c=![]() 可知所求待测液的浓度偏高,C正确;
可知所求待测液的浓度偏高,C正确;
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数,V(标)偏小,n(标)偏小,根据c=![]() 可知所求待测液的浓度偏低,D错误;
可知所求待测液的浓度偏低,D错误;
E.若滴定过程中刚出现颜色变化就停止滴定,则V(标)偏小,使n(标)偏小,根据c=![]() 可知所求待测液的浓度偏低,E错误;
可知所求待测液的浓度偏低,E错误;
故合理选项是AC;
II. (5) AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,所以溶液中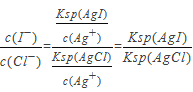 =
=![]() =4.7×10-7;
=4.7×10-7;
(6) Kb=![]() =1.8×10-5,c(NH3H2O)= 2.0 mol/L,则c(OH-)×c(NH4+)=Kh×c(NH3H2O)=3.6×10-5(mol/L)2,所以c(OH-)=c(NH4+)=6.0×10-3mol/L;
=1.8×10-5,c(NH3H2O)= 2.0 mol/L,则c(OH-)×c(NH4+)=Kh×c(NH3H2O)=3.6×10-5(mol/L)2,所以c(OH-)=c(NH4+)=6.0×10-3mol/L;
Ka2=![]() =6.2×10-8,c(H+)=c(OH-)=1.0×10-7mol/L,则溶液中
=6.2×10-8,c(H+)=c(OH-)=1.0×10-7mol/L,则溶液中![]() =0.62。
=0.62。

【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___________。(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
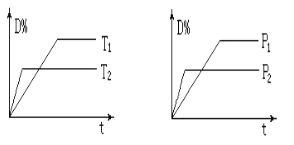
则该反应的ΔH=_________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________。

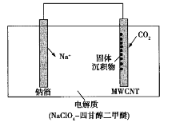
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O2+6e![]() 6O2
6O2
6CO2+6O2![]() 3C2O42
3C2O42
反应过程中O2的作用是________。
该电池的总反应式:________。