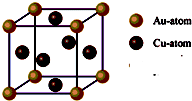
题目内容
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.则10min内CO的平均反应速率为
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①
(3)写出氢氧化铝在水中发生碱式电离的电离方程式:
欲使上述体系中Al3+浓度增加,可加入的物质是
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.则10min内CO的平均反应速率为
0.015mol/(L?min)
0.015mol/(L?min)
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①
CO或(CO2)的生成速率与消耗速率相等
CO或(CO2)的生成速率与消耗速率相等
②CO(或CO2)的质量不再改变
CO(或CO2)的质量不再改变
(3)写出氢氧化铝在水中发生碱式电离的电离方程式:
Al(OH)3?Al3++3OH-
Al(OH)3?Al3++3OH-
欲使上述体系中Al3+浓度增加,可加入的物质是
盐酸
盐酸
.分析:(1)①依据化学方程式结合平衡常数概念列式计算,结合化学反应速率概念;
②依据化学方程式计算消耗一氧化碳,利用单位时间内物质浓度的变化计算得到反应速率;
(2)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变分析;
(3)氢氧化铝在水中发生碱式电离,生成铝离子和氢氧根离子,依据电离平衡影响因素分析判断.
②依据化学方程式计算消耗一氧化碳,利用单位时间内物质浓度的变化计算得到反应速率;
(2)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变分析;
(3)氢氧化铝在水中发生碱式电离,生成铝离子和氢氧根离子,依据电离平衡影响因素分析判断.
解答:解:(1)①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),平衡常数K=
,故答案为:
;
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.物质的量为0.2mol,消耗一氧化碳物质的量为0.3mol,则10min内CO的平均反应速率=
=0.015mol/(L?min),故答案为:0.015mol/(L?min);
(2)①反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变,所以一氧化碳或二氧化碳的消耗速率和生成速率相同说明平衡,或一氧化碳或二氧化碳的质量分数不变,故答案为:CO或(CO2)的生成速率与消耗速率相等;CO(或CO2)的质量不再改变;
(3)氢氧化铝在水中发生碱式电离,是多元弱碱一步写出电离,电离方程式为Al(OH)3?Al3++3OH-;欲使上述体系中Al3+浓度增加,使电离平衡正向进行,可以加入酸如盐酸,故答案为:Al(OH)3?Al3++3OH-;盐酸.
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.物质的量为0.2mol,消耗一氧化碳物质的量为0.3mol,则10min内CO的平均反应速率=
| ||
| 10min |
(2)①反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变,所以一氧化碳或二氧化碳的消耗速率和生成速率相同说明平衡,或一氧化碳或二氧化碳的质量分数不变,故答案为:CO或(CO2)的生成速率与消耗速率相等;CO(或CO2)的质量不再改变;
(3)氢氧化铝在水中发生碱式电离,是多元弱碱一步写出电离,电离方程式为Al(OH)3?Al3++3OH-;欲使上述体系中Al3+浓度增加,使电离平衡正向进行,可以加入酸如盐酸,故答案为:Al(OH)3?Al3++3OH-;盐酸.
点评:本题考查化学平衡的影响因素分析,反应速率的计算应用,化学平衡标志的分析,题目难度中等.

练习册系列答案
相关题目
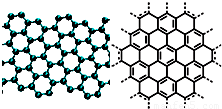
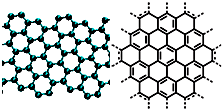 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右: