题目内容
 (2013?潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
(2013?潍坊模拟)(1)恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(N3H)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
0.4mol/L
0.4mol/L
,平衡常数K=0.1(L/mol)2
0.1(L/mol)2
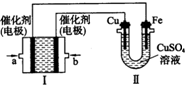
.(2)如图,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
①b处电极上发生的电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.②电镀结束后,装置Ⅰ中溶液的pH
变小
变小
,装置Ⅱ中Cu2+的物质的量浓度不变
不变
.(填“变大”“变小”或“不变”)③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置I中理论上消耗甲烷
1.12
1.12
L(标准状况下).分析:(1)依据图表数据判断平衡时氨气浓度为0.20mol/L,结合起始量,利用活性平衡三段式列式计算平衡浓度,根据平衡常数概念用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积计算平衡常数;
(2)图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极;
①b处是氧气得到电子发生的电极反应;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH减小;装置Ⅱ是电镀阳极电极反应可知,铜离子浓度不变;
③依据原电池和电解池中电子守恒计算消耗甲烷的体积;
(2)图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极;
①b处是氧气得到电子发生的电极反应;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH减小;装置Ⅱ是电镀阳极电极反应可知,铜离子浓度不变;
③依据原电池和电解池中电子守恒计算消耗甲烷的体积;
解答:解:(1)图表数据判断平衡时氨气浓度为0.20mol/L,物质的量为0.20mol/L×2L=0.40mol,结合起始量,利用活性平衡三段式列式计算平衡浓度
N2+3H2=2NH3
起始量(mol) 1 2.6 0
变化量(mol) 0.2 0.6 0.4
平衡量(mol) 0.8 2 0.4
得到平衡后物质浓度c(N2)=0.4mol/L;c(H2)=1molL,c(NH3)=0.2mol/L
K=
=
=0.1(L/mol)2,
故答案为:0.4mol/L;0.1(L/mol)2;
(2)图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极;
①b处是氧气得到电子发生的电极反应;电极反应为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH减小;装置Ⅱ是电镀阳极电极反应可知,阳极电极反应为:Cu-2e-=Cu2+,阴极电极反应为:Cu2++2e-=Cu,铜离子浓度不变;
故答案为:减小,不变;
③装置Ⅱ中阴极电极反应为Cu2++2e-=Cu,质量增加12.8g为铜物质的量为0.2mol,转移电子为0.4mol,装置I中负极电极反应为:CH4+10OH--8e-=CO32-+7H2O理论上消耗甲烷物质的量为:0,05mol,标准状况下的体积=0.05mol×22.4L/mol=1.12L;
故答案为:1.12;
N2+3H2=2NH3
起始量(mol) 1 2.6 0
变化量(mol) 0.2 0.6 0.4
平衡量(mol) 0.8 2 0.4
得到平衡后物质浓度c(N2)=0.4mol/L;c(H2)=1molL,c(NH3)=0.2mol/L
K=
| c2(NH3) |
| c3(H2)c(N2) |
| 0.22 |
| 0.4×13 |
故答案为:0.4mol/L;0.1(L/mol)2;
(2)图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极;
①b处是氧气得到电子发生的电极反应;电极反应为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH减小;装置Ⅱ是电镀阳极电极反应可知,阳极电极反应为:Cu-2e-=Cu2+,阴极电极反应为:Cu2++2e-=Cu,铜离子浓度不变;
故答案为:减小,不变;
③装置Ⅱ中阴极电极反应为Cu2++2e-=Cu,质量增加12.8g为铜物质的量为0.2mol,转移电子为0.4mol,装置I中负极电极反应为:CH4+10OH--8e-=CO32-+7H2O理论上消耗甲烷物质的量为:0,05mol,标准状况下的体积=0.05mol×22.4L/mol=1.12L;
故答案为:1.12;
点评:本题考查化学平衡的判断,化学平衡的三段式计算应用,平衡常数概念的计算应用,原电池、电解池原理的计算应用和电极书写方法,题目难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案
相关题目
 (2013?潍坊模拟)如图,“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放.下列行为不利于低碳生活的是( )
(2013?潍坊模拟)如图,“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放.下列行为不利于低碳生活的是( ) (2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.