题目内容
【题目】(1)下图是金属镁和卤素单质(X2)反应的能量变化示意图。
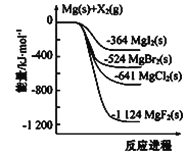
写出MgBr2(s)与Cl2(g)生成MgCl(s)和Br2(l)的热化学方程式______________________________。
(2)甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。当电池中有2mol e-发生转移时,左右两侧溶液的质量之差为______g(假设反应物耗尽,忽略气体的溶解)。

(3)250mLK2SO4和CuSO4的混合溶液中c(SO42-)=0. 5mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况下)。假定电解后溶液体积仍为250mL,写出阴极电极反应式______________原混合溶液中c(K+)=__________________
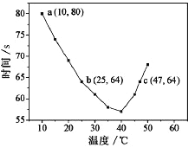
(4)NaHSO3溶液在不同温度下均可被过量![]() KIO3氧化。将浓度均为0.020mol/L
KIO3氧化。将浓度均为0.020mol/L![]() NaHSO3溶液(含少量淀粉)10ml
NaHSO3溶液(含少量淀粉)10ml![]() 、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的
、KIO3(过量)酸性溶液90.0ml混合,记录10—55℃间溶液变蓝时间,实验结果如图。据图分析,图中a点对应的![]() NaHSO3反应速率为________________
NaHSO3反应速率为________________
【答案】MgBr2(s) + Cl2(g) = MgCl(s)+ Br2(l)ΔH=-117kJ/mol 24 Cu2+ + 2e— = Cu,2H+ + 2e— = H2 0.6mol/L 2.5×10—5mol/L·s
【解析】
(1)依据图像分析可知,①Mg(s)+Cl2(g)=MgCl2(s), ΔH=-641 kJ/mol;②Mg(s)+Br2(g)=MgBr2(s), ΔH=-524 kJ/mol;根据盖斯定律,①-②得:MgBr2(s) + Cl2(g) = MgCl(s)+ Br2(l)ΔH=-117kJ/mol;综上所述,本题答案是:MgBr2(s) + Cl2(g) = MgCl(s)+ Br2(l)ΔH=-117kJ/mol。
(2)负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移2mol电子时,左侧质量减轻2/6×(44-32)=4g,还要有2molH+通过质子交换膜进入右侧,质量减少2g;正极反应式为O2+4H++4e-=2H2O,右侧质量增加32×2/4=16g,加上转移过来的2gH+,因此左右两侧溶液的质量之差为16+4+2+2=24g;因此,本题正确答案是:24。
(3)石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况),阳极发生:4OH--4e﹣= O2↑+2H2O,生成氧气的量=1.12/22.4=0.05mol;则转移的电子的量为0.2 mol;阴极发生Cu2++2e﹣═Cu、2H++2e-=H2↑,则生成氢气的量=1.12/22.4=0.05mol;根据电子得失守恒,消耗铜离子的量为0.05 mol,溶液中铜离子浓度=0.05/0.25=0.2 mol·L-1,根据电荷守恒可知:0.2×2+c(K+)×1=0.5×2, c(K+)=0.6mol/L;综上所述,本题答案是:Cu2+ + 2e— = Cu,2H+ + 2e— = H2 ; 0.6mol/L。
(4)a点时间为80s,混合液的体积为90+10=100![]() mL=0.1L,浓度变化量为0.02×0.01/0.1=0.002mol/L,a点对应的NaHSO3反应速率为0.002/80= 2.5×10—5mol/L·s;综上所述,本题答案是:2.5×10—5mol/L·s。
mL=0.1L,浓度变化量为0.02×0.01/0.1=0.002mol/L,a点对应的NaHSO3反应速率为0.002/80= 2.5×10—5mol/L·s;综上所述,本题答案是:2.5×10—5mol/L·s。

 学习实践园地系列答案
学习实践园地系列答案【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行