题目内容
【题目】关于各实验操作,下列说法错误的是
A. 蒸馏前应往蒸馏烧瓶中加入少量沸石
B. 取用金属钠时,多余的钠应放回煤油中
C. 容量瓶用蒸馏水洗净后必须烘干才能使用
D. 可用焰色反应鉴别NaCl和KCl固体
【答案】C
【解析】
A项、蒸馏前加入沸石或碎瓷片可防止暴沸,A正确;
B项、钠易燃,取用金属钠时,多余的钠应放回煤油中,B正确;
C项、容量瓶用蒸馏水洗净后,有水残留对实验无影响,不需要烘干,C错误;
D项、鉴别NaCl和KCI,可根据Na和K元素的焰色反应现象不同检验,D正确;
故本题选C。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
(1)H2或CO可以催化还原NO以达到消除污染的目的.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJmol﹣1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 .
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.图表示在其他条件不变时,反应:2CO(g)+2NO(g)2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.
①该反应的△H0 (填“>”或“<”).
②若催化剂的表面积S1>S2 , 在右图中画出c (NO) 在T1、S2条件下达到平衡过程中的变化曲线 . 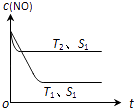
(3)在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:![]()
时间/s | 0 | 1 | 2 | 3 | 4 |
c (NO)(×10﹣3 molL﹣1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
c (CO)(×10﹣3 molL﹣1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
不考虑温度变化对催化剂催化效率的影响,按要求完成以下计算(写出计算过程,只写出计算结果的不给分):①计算前2s内的△c (CO2);
②计算前2s内的平均反应速率v (N2);
③计算达到平衡时NO的转化率.