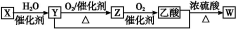
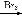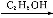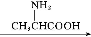题目内容
下述实验设计能够达到目的的是( )
编号实验目的实验设计
A除去CO2中少量的SO2将混合气体通过饱和Na2CO3溶液
B除去Cu粉中混有的CuO向混合物中滴加适量稀硝酸
C检验溶液中是否含有Fe2+向溶液中滴入氯水后,再滴加KSCN
溶液
D证明H2CO3酸性比H2SiO3强将CO2通入Na2SiO3溶液中
D
【解析】CO2和SO2都与Na2CO3溶液反应,应选择饱和NaHCO3溶液,A项错误;Cu粉与稀硝酸反应,B项错误;检验Fe2+,应先滴加KSCN 溶液,不显红色,再滴入氯水,C项错误;将CO2通入Na2SiO3溶液中得到H2SiO3白色沉淀即可证明H2CO3酸性比H2SiO3强,D项正确。

练习册系列答案
相关题目
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的溶度积。25 ℃时,在AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下:
物质 | AgCl | AgI | Ag2S |
颜色 | 白 | 黄 | 黑 |
Ksp(25 ℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述不正确的是( )
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25 ℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25 ℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同