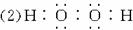题目内容
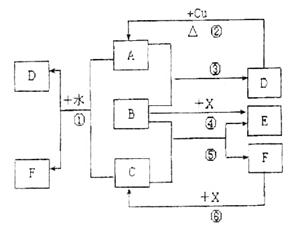
(10分)已知A~F是中学化学常见的物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E。反应中部分生成物已略去。试回答下列问题:
(1)写出B的电子式 ,化学键类型 。
(2)根据图中信息,B、C、X氧化性从强到弱的顺序是________________________。
(3)X与铝高温下反应的方程式为______________。
(4)写出反应②的化学方程式_____________。
(5)反应①的离子方程式 。
(1) ,极性键和非极性键。
,极性键和非极性键。
(2)X>C>B(或写作MnO2>Cl2>H2O2)
(3)3MnO2+4Al 3Mn+2Al2O3
3Mn+2Al2O3
(4)
(5)Cl2+SO2+2H2O=4H++SO42-+2Cl-
解析试题分析:F是气体,它能形成浓溶液,说明F极易溶于水,中学阶段只可能是氨气或氯化氢,又因为F的浓溶液能与黑色粉末X反应用于实验室制备单质气体C,实验室能用黑色粉末与溶液反应制备的气体只有氯气,结合氨水和盐酸的性质,可知:C是Cl2,F是HCl,X是MnO2,进而推知A是SO2,B是H2O2,E是O2.D为硫酸。然后根据氧化还原反应中氧化剂比氧化产物的氧化性强等推知答案.
考点:无机物的推断
点评:本题要根据物质性质的特殊性来寻找突破口,如D是一种不挥发性酸,其浓溶液有强氧化性,则D为硫酸。本题还需要从众多的物质和化学反应中筛选出符合题意的物质来。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目