��Ŀ����
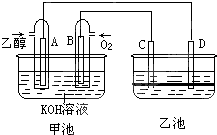 ��ͼ�׳غ��ҳ��е��ĸ��缫���Ƕ��Բ��ϣ��ҳ���Һ�ֲ㣬�ϲ���ҺΪ����Һ�������ԣ������ͼʾ�ش��������⣺
��ͼ�׳غ��ҳ��е��ĸ��缫���Ƕ��Բ��ϣ��ҳ���Һ�ֲ㣬�ϲ���ҺΪ����Һ�������ԣ������ͼʾ�ش��������⣺��1��ͨ���Ҵ���C2H5OH���Ķ��Ե缫�ĵ缫��ӦʽΪ
��2�����ҳط�Ӧ�����У����Թ۲쵽
��3�����ڳ��³�ѹ�£�1gC2H5OHȼ������CO2��Һ̬H2Oʱ�ų�29.71kJ��������ʾ�÷�Ӧ���Ȼ�ѧ����ʽΪ
��2�����ҳ��У��ҳ���Һ�ֲ㣬�ϲ���ҺΪ����Һ�����ʱ�����������ӷŵ�ͬʱ�������������ӣ���������֪���缫��Ӧ�к�ⵥ�����ɣ����ϲ�������Һ��Ϊ�����Եĵ��Σ������ϵ�����ʧ���ӷ���������Ӧ��
��3��1g�Ҵ������ʵ���=
| 1 |
| 46 |
���׳ؿ��Գ�磬B�缫��Ӧ��ʧ���ӷ���������Ӧ������Ӧ�����Դ�����������������������Һʱ��B�缫������������ʧ���������������缫��ӦʽΪ4OH--4e-=2H2O+O2����
�ʴ�Ϊ��C2H5OH+16OH--12e-=2CO32-+11H2O��4OH--4e-=2H2O+O2����
��2�����ҳ��У�C��������D�������������ϵ�����ʧ���ӷ���������Ӧ���缫��ӦʽΪ 2I--2e?=I2��������ˮ��Һ�����غ�ɫ������C�缫���������غ�ɫ��
�ʴ�Ϊ��C�� 2I--2e?=I2 ��
��3��1g�Ҵ������ʵ���=
| 1 |
| 46 |
�ʴ�Ϊ��C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l����H=-1366.7kJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���ҵ���õ�ⱥ��NaCl��Һ�ķ�������ȡNaOH��Cl2��H2����������Ϊԭ������һϵ�л�����Ʒ����Ϊ�ȼҵ��
��1����������Ĥ��������ʳ��ˮʱ��Cl2����NaOH��ֽӴ������²������NaClO��H2����Ĥ��������ʳ��ˮ��Ӧ�����ӷ���ʽΪ ��
��2���ȼҵ���ܸߣ�һ�ֽ�������ȼ�ϵ������ϵ��¹��տ��Խڣ��磩��30�����ϡ������ֹ�������У�������ϵĴ�����ת����ϵ����ͼ��ʾ�����еĵ缫δ��������õ�����Ĥ��ֻ����������ͨ����

�پ����Ƶı���NaCl��ҺӦ��ͼ�е��ص� ����д���� ���ҡ�����ע�롣
��ͼ��X��____ __���ѧʽ�����������ҵĵ缫��ӦʽΪ�� _ ��ͼʾ������������Һ��������a����b���Ĺ�ϵ�� ������ĸ����
A. a%=b% B. a%��b% C. a%��b%
�ۼ��е����ӽ���ĤΪ ��������ӽ���Ĥ���������ӽ���Ĥ������
��3���ȼҵ�IJ���NaOH�벻ͬ���ʷ�Ӧ�������ɲ�ͬ���Ρ���֪�����£�Ũ�Ⱦ�Ϊ0.1 mol/L��4��������ҺpH���±���
|
���� |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
|
pH |
11.6 |
9.7 |
10.3 |
5.2 |
����˵���У�����ȷ���� ������ĸ��
a������ˮ�м���NaHCO3������������ˮ�д������Ũ��
b��������Һ�У�ˮ�ĵ���̶�������NaClO
c�������£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH������H2SO3
d��NaHSO3��Һ������Ũ�ȴ�С˳��Ϊc��Na+��> c��H+��>c��HSO3-�� >c��SO32-��>c��OH-��

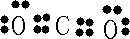
 H++Cl-+HClO
H++Cl-+HClO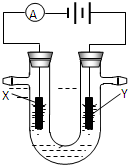

 2PbSO4(s) +2H2O(l)�����һ��ʱ�����c����d�������ֱ�μӷ�̪�Լ���c��������Һ��죬����˵����ȷ����____________����д��ţ���
2PbSO4(s) +2H2O(l)�����һ��ʱ�����c����d�������ֱ�μӷ�̪�Լ���c��������Һ��죬����˵����ȷ����____________����д��ţ��� 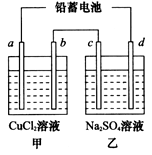
 H++A2-��
H++A2-��  CH3OH(g) ��H=-90.8kJ/mol
CH3OH(g) ��H=-90.8kJ/mol  CH3OCH3(g)+H2O(g) ��H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) ��H=-23.5kJ/mol  CO2(g)+H2(g) ��H=-41.3kJ/mol
CO2(g)+H2(g) ��H=-41.3kJ/mol  2SO3(g)����һ���¶��£���0.23molSO2��0.11molO2ͨ���ݻ�Ϊ1L���ܱ������з�����Ӧ���ﵽƽ���õ�0.12molSO3����Ӧ��ƽ�ⳣ��K=__________�����¶Ȳ��䣬��ͨ��0.50molO2�����´ﵽƽ�⣬��SO3�����������__________����������䡱��С������
2SO3(g)����һ���¶��£���0.23molSO2��0.11molO2ͨ���ݻ�Ϊ1L���ܱ������з�����Ӧ���ﵽƽ���õ�0.12molSO3����Ӧ��ƽ�ⳣ��K=__________�����¶Ȳ��䣬��ͨ��0.50molO2�����´ﵽƽ�⣬��SO3�����������__________����������䡱��С������