题目内容
16.下列说法不正确的是( )| A. | CO2和N2O摩尔质量相等 | |
| B. | 18g水中含有1molH2O | |
| C. | O2的摩尔质量(单位是g•mol-1)在数值上等于其相对分子质量 | |
| D. | 1mol•L-1NaCl溶液中含1molNa+ |
分析 A、相对原子质量总和来计算摩尔质量分析;
B、物质的量n=$\frac{m}{M}$;
C、摩尔质量数值上等于其相对分子质量;
D、溶液体积不知不能计算微粒物质的量.
解答 解:A、相对原子质量总和来计算摩尔质量,CO2和N2O摩尔质量为44g/mol,所以摩尔质量相等,故A正确;
B、物质的量n=$\frac{m}{M}$=$\frac{18g}{18g/mol}$=1mol/L,则18g水中含有1molH2O分子,故B正确;
C、摩尔质量数值上等于其相对分子质量,O2的摩尔质量(单位是g•mol-1)在数值上等于其相对分子质量为32,故C正确;
D、1mol•L-1NaCl溶液中,溶液体积不知不能计算微粒物质的量,故D错误;
故选D.
点评 本题考查了摩尔质量概念的分析判断,注意实质理解和数值确定,掌握基础是解题关键,题目较简单.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
7.下列四种演示金属钾与水反应的实验装置,正确的是( )
| A. | 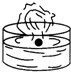 | B. | 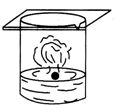 | C. | 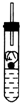 | D. | 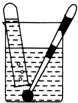 |
4.下列有关物质性质的应用正确的是( )
①浓硝酸见光易分解,需储存在棕色试剂瓶
②二氧化碳是酸性氧化物,通入氯化钙溶液中有白色沉淀生成.
③一氧化氮和二氧化氮都是造成光化学烟雾的主要气体
④一氧化碳有剧毒,不可以用来冶炼金属铁.
①浓硝酸见光易分解,需储存在棕色试剂瓶
②二氧化碳是酸性氧化物,通入氯化钙溶液中有白色沉淀生成.
③一氧化氮和二氧化氮都是造成光化学烟雾的主要气体
④一氧化碳有剧毒,不可以用来冶炼金属铁.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
1.A、B、C、D、E、F为六种短周期元素,已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C是地壳中含量最高的元素;在元素周期表中,F和C是周期不同、族相邻的关系,且F和E的原子序数之和为30,它们两两形成的化合物为甲、乙、丙、丁、戊、,这五种化合物中原子个数比如下表:(用元素符号作答)
(1)写出F在周期表中的位置:第三周期VIIA族;
(2)向甲的水溶液中加入MnO2,氧化产物是O2(填化学式);已知有机物乙的分子为直线结构,乙的分子式为C2H2;
(3)若E单质可以与D的最高价氧化物的水化物溶液发生反应,请写出该反应化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)以E单质为阳极,在H2SO4溶液中电解,可以在E表面形成致密氧化膜保护E材料不被腐蚀,写出阳极电极反应式为2Al+3H2O-6e-=Al2O3+6H+.
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 化合物中各元 素原子个数比 | A:C=1:1 | A:B=1:1 | D:C=1:1 | E:F=1:3 | B:F=1:4 |
(2)向甲的水溶液中加入MnO2,氧化产物是O2(填化学式);已知有机物乙的分子为直线结构,乙的分子式为C2H2;
(3)若E单质可以与D的最高价氧化物的水化物溶液发生反应,请写出该反应化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(4)以E单质为阳极,在H2SO4溶液中电解,可以在E表面形成致密氧化膜保护E材料不被腐蚀,写出阳极电极反应式为2Al+3H2O-6e-=Al2O3+6H+.
8.下列各组变化中,每一转化在一定条件下均能一步实现的是( )


| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ①②③ |
5.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 硫酸氢钠溶液中加入足量的烧碱溶液:H++SO42-+OH-═SO42-+H2O | |
| C. | 过氧化钠与水反应:2O2-+2H2O═4OH-+O2↑ | |
| D. | 澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2═Ca2CO3↓+H2O |
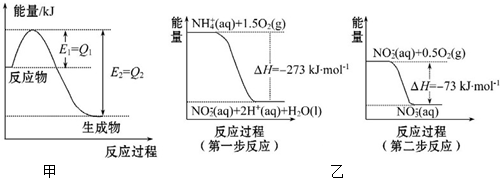
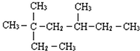 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯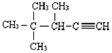 的系统名称为3,4,4-三甲基-1-戊炔.
的系统名称为3,4,4-三甲基-1-戊炔.