题目内容
将质量为1.15g钠用刺了孔的铝箔包裹后放入水中,共收集到1.232L(标准状况)气体.
请回答下列问题:
(1)1.15g钠与水反应,理论上生成气体的体积(标准状况)为______L.
(2)Al和NaOH溶液反应也能生成H2,写出相应的化学方程式,并用单线桥法标出电子转移方向和数目:______.
(3)若反应后溶液的体积为100mL,则溶液中NaOH和NaAlO2的物质的量浓度各为多少?
解:(1)设生成氢气的体积为xL.
2Na+2H2O=2NaOH+H2↑
46g 22.4L
1.15g xL
x=0.56
故答案为:0.56.
(2)铝和氢氧化钠、水反应生成偏氯酸钠和氢气,铝失电子发生氧化反应,水得电子发生还原反应,转移电子数为6.
故答案为:

(3)2Na+2H2O=2NaOH+H2↑
2mol 2mol
 0.05mol
0.05mol
钠与水反应生成的氢氧化钠的物质的量为0.05mol,生成氢气0.56L.
所以铝与氢氧化钠反应生成的氢气体积为1.232L-0.56L=0.672L
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol (3×22.4 )L
0.02mol 0.02mol 0.672L
与铝反应的氢氧化钠的物质的量为0.02mol,所以剩余氢氧化钠0.05mol-0.02mo=0.03moll,故氢氧化钠的物质的量浓度= ;
;
生成偏氯酸钠的物质的量为0.02mol,
所以偏氯酸钠的物质的量浓度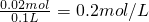
故答案为:0.3 mol?l-1;0.2 mol?l-1
分析:(1)根据钠与水的关系式计算;
(2)根据反应物、生成物写出反应方程式并标出电子转移的方向和数目;
(3)氢气的总体积减去钠与水反应生成氢气的体积就是铝与氢氧化钠反应生成的氢气体积,根据铝与氢氧化钠反应生成的氢气体积计算消耗的氢氧化钠的物质的量,钠与水反应计算生成的氢氧化钠的物质的量减去铝与氢氧化钠反应的物质的量就是剩余的氢氧化钠的物质的量,根据浓度公式计算其浓度;根据铝与氢氧化钠反应生成氢气的体积计算生成的偏氯酸钠的物质的量,根据浓度公式计算其浓度.
点评:本题以钠、铝的化学反应为载体考查了氧化还原反应的有关计算,计算时要注意氢气的来源,不仅包括钠与水反应生成的氢气,还包括铝和氢氧化钠反应生成的氢气.
2Na+2H2O=2NaOH+H2↑
46g 22.4L
1.15g xL
x=0.56
故答案为:0.56.
(2)铝和氢氧化钠、水反应生成偏氯酸钠和氢气,铝失电子发生氧化反应,水得电子发生还原反应,转移电子数为6.
故答案为:

(3)2Na+2H2O=2NaOH+H2↑
2mol 2mol
 0.05mol
0.05mol钠与水反应生成的氢氧化钠的物质的量为0.05mol,生成氢气0.56L.
所以铝与氢氧化钠反应生成的氢气体积为1.232L-0.56L=0.672L
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol (3×22.4 )L
0.02mol 0.02mol 0.672L
与铝反应的氢氧化钠的物质的量为0.02mol,所以剩余氢氧化钠0.05mol-0.02mo=0.03moll,故氢氧化钠的物质的量浓度=
 ;
; 生成偏氯酸钠的物质的量为0.02mol,
所以偏氯酸钠的物质的量浓度
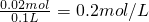
故答案为:0.3 mol?l-1;0.2 mol?l-1
分析:(1)根据钠与水的关系式计算;
(2)根据反应物、生成物写出反应方程式并标出电子转移的方向和数目;
(3)氢气的总体积减去钠与水反应生成氢气的体积就是铝与氢氧化钠反应生成的氢气体积,根据铝与氢氧化钠反应生成的氢气体积计算消耗的氢氧化钠的物质的量,钠与水反应计算生成的氢氧化钠的物质的量减去铝与氢氧化钠反应的物质的量就是剩余的氢氧化钠的物质的量,根据浓度公式计算其浓度;根据铝与氢氧化钠反应生成氢气的体积计算生成的偏氯酸钠的物质的量,根据浓度公式计算其浓度.
点评:本题以钠、铝的化学反应为载体考查了氧化还原反应的有关计算,计算时要注意氢气的来源,不仅包括钠与水反应生成的氢气,还包括铝和氢氧化钠反应生成的氢气.

练习册系列答案
相关题目
