题目内容
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。

完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O![]() CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。

①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是: 。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
【答案】(1)硝酸铅(或硫酸铜);黑色沉淀
(4)3:1
(3)价廉;吸收CO2能力差
碱液循环使用;2KHCO3→K2CO3+CO2↑+H2O
(4)①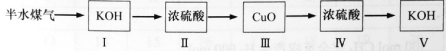
②除去半水煤气中的CO2(包括H2S)和H2O
③IV
【解析】
试题分析:(1)硫化氢能与重金属生成沉淀,所以将半水煤气样品通入硝酸铅(或硫酸铜)溶液中,出现黑色沉淀可以证明有硫化氢存在。
(2)若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后CO转化为氢气,则根据方程式可知所得的气体中:V(H2):V(N2)=(38+28):22=3:1。
(3)根据表中数据可知若选择Na2CO3碱液作吸收液,其优点是价廉,而缺点是吸收CO2能力差。由于生成的碳酸氢钾受热易分解产生碳酸钾,所以使碱液循环使用可以降低成本,反应的化学方程式为2KHCO3→K2CO3+CO2↑+H2O;
(4)①由于半水煤气中含有二氧化碳,所以首先利用碱液除去二氧化碳,干燥后再通过氧化铜反应,利用浓硫酸吸收产生的水蒸气,利用碱液吸收产生的二氧化碳,进而计算体积分数。所以流程为
 。
。
②由于半水煤气中含有二氧化碳,所以首先利用碱液除去二氧化碳,干燥后再通过氧化铜反应。故答案为:除去半水煤气中的CO2(包括H2S)和H2O。
③氢气还原氧化铜生成水蒸气,浓硫酸吸收水蒸气,所以该实验方案中,步骤Ⅳ可以确定半水煤气中H2的体积分数。故答案为:Ⅳ。