题目内容
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,所得滤液B显酸性。
①滤液A中加入漂白液的目的是:___________________________(用离子方程式表示)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)___________。
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
离子方程式为____________。
(2)由滤液B制备少量无水AlCl3(AlCl3极易在空气中水解)涉及的操作为:____________、冷却结晶、_________(填操作名称)、洗涤。
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)___________。

(4)若将铝土矿溶于足量的氢氧化钠溶液,则对应的离子方程式为____________________。
【答案】 2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+ C Al3++3NH3·H2O =Al(OH)3↓+3NH4+ 边滴加浓盐酸边蒸发浓缩 过滤 B SiO2 +2OH- = SiO32- + H2O,Al2O3 + 2OH- + 3H2O = 2Al(OH)4-或Al2O3+2OH-+=2AlO2-+H2O
【解析】(1)①滤液中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性,次氯酸根离子具有氧化性氧化亚铁离子为铁离子在溶液中形成氢氧化铁沉淀除去;亚铁离子被氧化为铁离子在溶液中形成氢氧化铁沉淀,次氯酸根离子被还原为氯离子;反应的两种方程式为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+;故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+;
②A、氢氧化钠溶液可以沉淀铝离子但过了会溶解氢氧化铝,故A不是最好; B.硫酸溶液不能沉淀铝离子,故B不符合;C.氨水是弱碱不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,反应的离子方程式为Al3++3NH3·H2O =Al(OH)3↓+3NH4+,故C符合;D.二氧化碳和氯化铝不反应不能生成氢氧化铝沉淀,故D不符合;故答案为:C;Al3++3NH3·H2O =Al(OH)3↓+3NH4+;
(2)由滤液B制备少量无水AlCl3,由于AlCl3极易在空气中水解,需要边滴加浓盐酸边蒸发浓缩、冷却结晶、过滤、洗涤,故答案为:边滴加浓盐酸边蒸发浓缩;过滤;
(3)A、蒸发皿中含有二氧化硅和氢氧化钠反应,故A不符合;B、铁坩埚可以熔融二氧化硅和氢氧化钠,故B符合;C、玻璃中含二氧化硅和氢氧化钠反应,故C不符合;D、烧杯不能用于固体高温加热,故D不符合;故答案为:B;
(4)氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,离子反应分别为Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O。

 课时训练江苏人民出版社系列答案
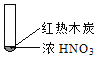
课时训练江苏人民出版社系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】氯化铁在现代生产和生活中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做了如下探究实验。
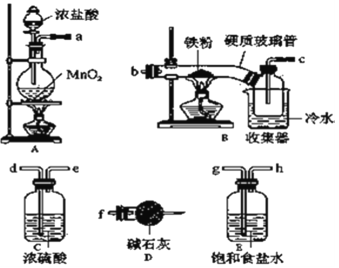
已知:Ⅰ.无水氯化铁在空气中易潮解,加热易升华;
Ⅱ.工业上,向500~600℃的铁屑中通入氯气可生产无水氯化铁;
Ⅲ.向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
请回答下列问题:
(1)装置的连接顺序为 _____________(按气流从左向右的方向,填仪器接口字母)。
(2)装置D的作用是 _________;
若缺少装置E对本实验造成的影响是_________________________________________。
(3)工业生产中,会将装置D中的干燥剂换成无水氯化钙,通过装置D后产生的过量氯气再用氯化亚铁溶液吸收,得到氯化铁溶液作为副产品。氯化亚铁溶液因吸收Cl2失去作用而失效,下列试剂中能够检验氯化亚铁溶液是否完全失效的所用的试剂是_____________。
(4)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验: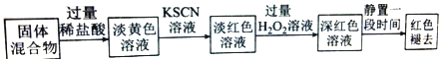
淡红色溶液中加入过量H2O2后溶液红色加深的原因是 __________ (用离子方程式表示)。
实验 | 操作 | 现象 | |
实验甲:取褪色后溶液3等份 | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
第2份 | 滴加KSCN溶液 | 溶液变为红色 | |
第3份 | 滴加稀盐酸和BaCl2 | 产生白色沉淀 | |
实验乙:取与褪色后溶液同浓度的FeCl3溶液 | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
根据实验现象判断,以下说法不正确的是 _____(填选项字母)。
A. 实验甲说明是Fe3+发生了反应而不是SCN—发生反应
B. 实验甲说明是SCN—发生了反应而不是Fe3+发生反应
C.实验甲中第3份溶液中生成的白色沉淀为BaSO4
D.实验乙排除H2O2分解产生的O2氧化SCN—的可能
由实验甲和乙得出的结论为______________________________ 。
【题目】在一密闭容器中加入A,B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:据此下列结论中正确的是( )
测定时刻/s | t1 | t2 | t3 | t4 |
C(A)/molL﹣1 | 6 | 3 | 2 | 2 |
C(B)/molL﹣1 | 5 | 3.5 | 3 | 3 |
C(C)/molL﹣1 | 1 | 2.5 | 3 | 3 |
A.在容器中发生的反应为2A(g)+B(g)2C(g)
B.该温度下,此反应的平衡常数为0.25
C.A的转化率比B转化率的低
D.在t3时刻反应已经停止