��Ŀ����
����Ŀ����֪X��Y��Z��W��V��U�Ƕ����ڵ�����Ԫ�أ�ԭ��������������X��Vͬ���壬����W�����γ�A2B��A2B2�ͻ����Z��W�ĵ��ʳ����¾�Ϊ��ɫ���壻Y��Uͬ������Yԭ�ӵ�L���������K���������2�����Իش��������⣺
��1��д��UԪ�������ڱ��е�λ����V���ӽṹʾ��ͼΪ��YW2�ĵ���ʽ ��
��2��Y��U�ļ��⻯����ȶ���������ǿ��˳���� ��
��3��V������������ˮ���ﲻ��ʹ�ò������Լ�ƿʢ�ŵ�ԭ���� �� ���û�ѧ����ʽ��ʾ��
��4����X��Z��ɵ�һ�ֻ����ﻯѧʽΪZX5 �� ���ԭ�Ӿ��ﵽͬ����ϡ������ԭ�ӵ��ȶ��ṹ������������������ӡ����ۡ��������
��5��X��Y��Z��W����Ԫ�أ���˳�����ԭ�Ӹ�����Ϊ5��1��1��3�Ļ�����û������ϡ��Һ����������������Һ�ڼ��������·�Ӧ�����ӷ���ʽΪ�� ��
���𰸡�
��1����3���ڵ�IVA�壻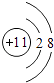 ��
��![]()
��2��SiH4��CH4
��3��SiO2+2NaOH=Na2SiO3+H2O
��4������
��5��NH4++HCO3��+2OH�� ![]() NH3��+CO32��+2H2O
NH3��+CO32��+2H2O
���������⣺X��Y��Z��W��V��U�Ƕ����ڵ�����Ԫ�أ�ԭ��������������Yԭ�ӵ�L���������K���������2��������L�������Ϊ4����YΪCԪ�أ�Y��Uͬ���壬��UΪSi��Z��W�ĵ��ʳ����¾�Ϊ��ɫ���壬����ԭ������������̼����ZΪNԪ�ء�WΪOͬʱ��X��Vͬ���壬����W�����������γ�A2B��A2B2�ͻ������XΪHԪ�ء�VΪNa��
��1.��UΪSi��Ԫ�������ڱ��е�λ�ã���3���ڵ�IVA�壬Na+���ӽṹʾ��ͼΪ 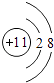 ��CO2�ĵ���ʽΪ
��CO2�ĵ���ʽΪ ![]() �����Դ��ǣ���3���ڵ�IVA�壻
�����Դ��ǣ���3���ڵ�IVA�壻 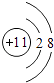 ��
�� ![]() ��
��
��2.��Y��U�ļ��⻯��ֱ�ΪCH4��SiH4 �� �ǽ�����Si��C�����ȶ���������ǿ��˳����SiH4��CH4 ��
���Դ��ǣ�SiH4��CH4��
��3.��V������������ˮ����ΪNaOH������ʹ�ò������Լ�ƿʢ�ŵ�ԭ���ǣ�SiO2+2NaOH=Na2SiO3+H2O�����Դ��ǣ�SiO2+2NaOH=Na2SiO3+H2O��
��4.����H��N��ɵ�һ�ֻ����ﻯѧʽΪNH5 �� ���ԭ�Ӿ��ﵽͬ����ϡ������ԭ�ӵ��ȶ��ṹ���û�����ΪNH4H����笠��������⸺���ӹ��ɣ��������ӻ����
���Դ��ǣ����ӣ�
��5.��H��C��N��O����Ԫ�أ���˳�����ԭ�Ӹ�����Ϊ5��1��1��3�Ļ�����ΪNH4HCO3 �� �û������ϡ��Һ����������������Һ�ڼ��������·�Ӧ�����ӷ���ʽΪ��NH4++HCO3��+2OH�� ![]() NH3��+CO32��+2H2O��
NH3��+CO32��+2H2O��
���Դ��ǣ�NH4++HCO3��+2OH�� ![]() NH3��+CO32��+2H2O��
NH3��+CO32��+2H2O��

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�