题目内容
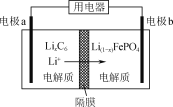
【题目】如下图所示可逆反应:mA(g) + nB(g) ![]() xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是
xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是

A. 上述反应是放热反应
B. 上述反应是吸热反应
C. m+n<x
D. m+n>x
【答案】AD
【解析】
根据第一个图到达平衡时所用时间的长短和斜率判断压强P1和P2的相对大小,增大压强,化学平衡向气体体积减小的方向移动,由此判断反应前后气体化学计量数的相对大小;根据第二个图判断,升高温度,化学平衡向吸热方向移动,再结合A的转化率判断该反应的正反应是放热还是吸热。
A.通过观察第二个图,发现随着温度的升高,A的转化率降低,说明升温平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,A正确;
B.通过观察第二个图,发现随着温度的升高,A的转化率降低,说明升温平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,B错误;
C.通过观察第一个图可知在P1条件下反应速率快,先达到平衡,所以确定P1>P2;增大压强,化学平衡向气体体积减小的方向移动,由图象知增大压强,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,即m+n>x,C错误;
D. 过观察第一个图可知在P1条件下反应速率快,先达到平衡,所以确定P1>P2;增大压强,化学平衡向气体体积减小的方向移动,由图象知,A的转化率增大,平衡向正反应方向移动,所以反应前的计量数大于反应后的计量数,即m+n>x,D正确;
正确答案:AD。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目