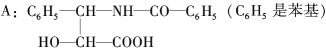题目内容
【题目】固体碘化铵置于密闭容器中,加热至一定温度后恒温,容器中发生反应:①NH4I(s)NH3(g)+HI(g) ②2HI(g)H2(g)+I2(g),测得平衡时c(I2)=0.5mol/L,反应①的平衡常数为20mol2/L2 , 则下列结论不正确的是( )
A.平衡时c(NH3)=5mol/L
B.平衡时HI分解率为20%
C.混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志
D.平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变
【答案】D
【解析】解:设反应①生成lNH3浓度为x,则①生成HI的浓度也为x, 测得平衡时c(I2)=0.5mol/L,则②
2HI(g) | H2(g)+ | I2(g) | ||
转化(mol/L) | 1 | 0.5 | 0.5 | |
平衡(mol/L) | x-1 | 0.5 | 0.5 |
可知
NH4I(s) | NH3(g)+ | HI(g) | ||
平衡 | x | x﹣1 |
根据反应①的平衡常数为20,则x(x﹣1)=20,解得x=5mol/L.
A.由以上分析可知平衡时c(NH3)=5mol/L,故A正确;
B.平衡时HI分解率为 ![]() =20%,故B正确;
=20%,故B正确;
C.因有固体参加,气体的质量变化,如密度不变时,可说明得到平衡状态,故C正确;
D.平衡后缩小容器体积,NH4I的物质的量增加,HI的物质的量减小,则平衡向生成HI的方向移动,I2的物质的量减小,故D错误.
故选D.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).

【题目】α,β,γ和δ4种生育三烯酚(见图)是构成维生素E的主要物质,下列叙述中不正确的是( ) 
α β γ δ | |
R1 | CH3 CH3 H H |
R2 | CH3 H CH3 H |
A.α和β两种生育三烯酚互为同系物,β和γ两种生育三烯酚互为同分异构体
B.4种生育三烯酚均可使酸性高锰酸钾溶液褪色
C.4种生育三烯酚都难溶于水
D.1 mol δ生育三烯酚与溴水发生反应,理论上最多可消耗3 mol Br2