��Ŀ����
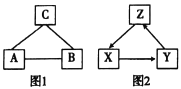
����Ŀ���Ȼ���ͭ��CuCl���������л��ϳɹ�ҵ�еĴ�������һ�ְ�ɫ��ĩ������ˮ���������Ҵ���ϡ���ᡣ��ͼ�ǹ�ҵ����ӡˢ��·��ʴ��Һ�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl��������CuCl�����̣�

��Ҫ��ش��������⣺
�� ��Һ�ٵ���Ҫ���еĽ�����������__________���ѧ���ţ���ͬ�����������ijɷ���_____________��YΪ__________��
����Һ����Z��Ӧ�����ӷ���ʽΪ��______________________��
�� д�����������ɶ�������Ļ�ѧ����ʽ_____________________��
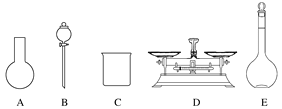
�� Ϊ�õ�������CuCl���壬��������_________�������������ϴ�ӡ�
a������ˮ b���Ҵ� c��ϡ���� d���Ȼ�ͭ��Һ
�� ���������е�����Һ��pH���ܹ����ԭ����___________________��
�� д������CuCl�����ӷ���ʽ_______________________��
�� �Ȼ���ͭ�Ķ���������
�� ��ȡ��Ʒ0.25g����10mL������FeCl3��Һ250mlL��ƿ�У�����ҡ����
�� ����Ʒ�ܽ��ˮ50mL��2��ָʾ����
�� ������0.10 mol��L��1���������Һ������ɫ����Ϊ�յ㣻
�� �ظ����Σ�������������Һƽ�����Ϊ25.00mL��
��֪��CuCl�ķ���ʽ��Ϊ99��CuCl + FeCl3 = CuCl2 + FeCl2�� Fe2+ + Ce4+ = Fe3+ + Ce3+��
��CuCl�Ĵ���Ϊ____________��
���𰸡��� Fe2+��1���� Fe��Cu��1���� HCl��1����
�� 2Fe2+ + Cl2 = 2Fe3+ + 2Cl�� �� 2Fe2+ +2H+ + H2O2 = 2Fe3+ + 2H2O ��2���������𰸼�����
�� Cu+2H2SO4��Ũ��![]() CuSO4+ SO2��+2H2O��2������д������1������ b��1����
CuSO4+ SO2��+2H2O��2�����������1������ b��1����
�� ��ֹ����������ͭ�������ֹCuClˮ����2����
�� SO2 + 2Cu2+ + 2Cl�� + 2H2O �T 2CuCl��+ SO42��+ 4H+ ��2���� �� 99% (2��)
��������
�����������ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl-��������������ۣ����������������۷�Ӧת��Ϊ���������ӣ�ͭ����������Ӧ����ͭ��Ȼ����ˣ�����Ϊ�������������ɵ�ͭ������ͭ���������ԣ��������������ᣬͭ�������Ӧ�����˵õ�������Ϊͭ����Һ���м���ZΪ��ˮ��˫��ˮ��������������Ϊ�����ӣ��õ�ʴ��Һ��Ȼ��ͭ��Ũ���ᷴӦ��������ͭ�Ͷ�������ͭ��������Ӧ�����Ȼ�ͭ������ͭ�����������Ȼ�ͭ��Ӧ�����Ȼ���ͭ��
��1��ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl-���������������������ܹ�ԭ����Ӧ���ɶ��������ӣ�ͭ�����ܹ�������Ӧ����ͭ�����˺������к���ͭ�������������ᣬ�������ᷴӦ�����Ȼ�������ͭ�������Ӧ����ͭ���������
��2���������Ϸ�����֪��Һ����Z��Ӧ�����ӷ���ʽΪ2Fe2+ + Cl2 = 2Fe3+ + 2Cl����2Fe2+ +2H+ + H2O2 = 2Fe3+ + 2H2O��
��3�����������ɶ�������ķ�Ӧ��ͭ��Ũ�����ڼ��������·�Ӧ���ɣ���Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ��![]() CuSO4+ SO2��+2H2O��
CuSO4+ SO2��+2H2O��
��4��Ϊ����CuCl����ʧ��������CuCl���岻��ˮ������ˮ�Ҵ�ϴ�ӣ���ѡb��
��5�����������е�����Һ��pH���ܹ����ԭ���Ƿ�ֹ����������ͭ�������ֹCuClˮ�⣻
��6������ͼʾ��֪��CuCl2��CuSO4��SO2��H2O��Ӧ����H2SO4��CuCl������CuCl�Ļ�ѧ����ʽ���ݵ�ʧ�����غ�õ���CuCl2+CuSO4+SO2+2H2O=2CuCl��+2H2SO4����Ӧ�����ӷ���ʽΪ��SO2 + 2Cu2+ + 2Cl�� + 2H2O �T 2CuCl��+ SO42��+ 4H+��
��7���ζ�0.25g��Ʒ�������������Һ��ƽ�������25.00ml����Ϸ���ʽ��֪��CuCl+FeCl3�TCuCl2+FeCl2��CuCl�Ĵ���Ϊ��25.00��103L��0.1mol/L��99g/mol��/0.25g��100%=99%��

 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�