题目内容
【题目】一种由氯化铵制取氯气的工艺原理如下:
反应Ⅰ.2NH4Cl+MgO![]() 2NH3↑+MgCl2+H2O↑
2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2![]() 2MgO+2Cl2
2MgO+2Cl2
下列说法正确的是
A. 该工艺中MgO可循环利用
B. 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L
C. 在800~1000℃条件下,O2的还原性强于Cl2的还原性
D. 若反应2NH3+MgCl2+H2O=2NH4Cl+MgO能自发进行,则该反应ΔH>0
【答案】A
【解析】A.根据反应Ⅰ和反应Ⅱ可知,该工艺中MgO可循环利用,故A正确;B. 根据反应Ⅰ和反应Ⅱ可知,理论上 2mol NH4Cl制得1molMgCl2,1molMgCl2可以制得1molCl2,则1mol NH4Cl制得0.5molCl2,但未注明气体的温度和压强,因此体积不一定是11.2L,故B错误;C. 根据反应Ⅱ,在800~1000℃条件下,O2的氧化性强于Cl2,故C错误;D. 反应2NH3+MgCl2+H2O=2NH4Cl+MgO的ΔS<0,根据当△G=△H-T△S<0时,反应能自发进行;则该反应ΔH<0,故D错误;故选A。

【题目】在一定温度下,已知可逆反应X(g)+3Y(g) ![]() 2Z(g),甲、乙两个恒温恒容的密闭容器中各物质浓度如下表所示:
2Z(g),甲、乙两个恒温恒容的密闭容器中各物质浓度如下表所示:
X(g) | Y(g) | Z(g) | ||
容器甲 | 初始浓度(mol/L) | 2.5 | y | 0 |
平衡浓度(mol/L) | x | 2.0 | 1.0 | |
容器乙 | t时刻浓度(mol/L) | 3.0 | 2.0 | 2.0 |
下列有关正确的是
A. x=3.5,Y=3.5 B. 平衡常数为1/6
C. 乙容器t时刻v(正)(逆) D. 因温度相等,平衡常数相同,故容器甲与容器乙中反应能达到等效平衡状态
【题目】在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g) ![]() 2C(g);△H<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);△H<0。达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
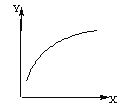
X | Y | |
A | 再加入A | B的百分含量 |
B | 再加入C | A的体积分数 |
C | 增大压强 | A的转化率 |
D | 升高高温度 | 混合气体平均摩尔质量 |
A. A B. B C. C D. D


