题目内容
【题目】按要求回答下列问题:
(1)已知拆开![]() 键、
键、![]() 键、
键、![]() 键分别需要吸收的能量为
键分别需要吸收的能量为![]() 、
、![]() 、
、![]() 。则由
。则由![]() 和
和![]() 反应生成1molHCl需要_______
反应生成1molHCl需要_______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() _________
_________![]() 的热量。
的热量。
![]() 可以在
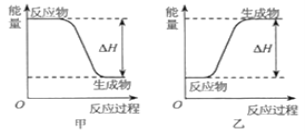
可以在![]() 中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____
中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____![]() 填“甲”或“乙”
填“甲”或“乙”![]() 。
。
(3)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 ![]() 。2min后,测得D的浓度为
。2min后,测得D的浓度为![]() mol/L ,
mol/L ,![]() ,C的反应速率是
,C的反应速率是![]() mol/(L·min)。则:
mol/(L·min)。则:
![]() 的值是__________;
的值是__________;
![]() 的平均反应速率是____________;
的平均反应速率是____________;
![]() 在2min末的浓度是________________;
在2min末的浓度是________________;
④若此后各物质的量均不再变化,则证明此可逆反应达到了_______的程度。
A.反应彻底 ![]() 反应终止
反应终止 ![]() 化学平衡
化学平衡 ![]() 无法判断
无法判断
【答案】放出 92.25 甲 2 0.125molL-1min-1 0.75mol/L C
【解析】
(1)依据焓变△H=反应物的化学键键能之和—生成物的化学键键能之和计算;
(2)H2可以在Cl2中安静地燃烧,该反应属于放热反应,据此判断;
(3)①根据v=![]() 计算出v(D),结合反应速率与化学计量数成正比计算x;②结合v(B)=
计算出v(D),结合反应速率与化学计量数成正比计算x;②结合v(B)=![]() v(D)计算;③经5min后D的浓度为0.5mol/L,D的物质的量为:2L×0.5mol/L=1mol,设A、B的初始浓度为n,根据三段式计算出n,再根据c=
v(D)计算;③经5min后D的浓度为0.5mol/L,D的物质的量为:2L×0.5mol/L=1mol,设A、B的初始浓度为n,根据三段式计算出n,再根据c=![]() 计算;④根据平衡状态的特征分析判断。
计算;④根据平衡状态的特征分析判断。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要的能量是436.4kJ、242.7kJ、431.8kJ,则反应:H2(g)+Cl2(g)=2HCl(g)的△H=436.4kJ/mol+242.7kJ/mol-2×431.8kJ/mol=-185.5kJ/mol,反应生成1molHCl需要放出92.25kJ的热量,故答案为:放出;92.25;
(2)H2可以在Cl2中安静地燃烧,该反应属于放热反应,反应物的总能量大于生成物的总能量,能表示该反应能量变化的是图甲;故答案为:甲;
(3)①经2min后,测得D的浓度为0.5mol/L,v(D)=![]() =0.25 mol/(Lmin),反应速率之比等于化学计量数之比,所以v(D)∶v(C)=0.25 mol/(Lmin)∶0.25mol/(Lmin)=2∶x,解得:x=2,故答案为:2;
=0.25 mol/(Lmin),反应速率之比等于化学计量数之比,所以v(D)∶v(C)=0.25 mol/(Lmin)∶0.25mol/(Lmin)=2∶x,解得:x=2,故答案为:2;
②v(D)=0.25 mol/(Lmin),则v(B)= ![]() v(D)=0.25 mol/(Lmin)×
v(D)=0.25 mol/(Lmin)×![]() =0.125 mol/(Lmin),故答案为:0.125 mol/(Lmin);
=0.125 mol/(Lmin),故答案为:0.125 mol/(Lmin);
③经2min后D的浓度为0.5mol/L,D的物质的量为:2L×0.5mol/L=1mol,设A、B的初始浓度为n,
3A(g) + B(g) ![]() 2C(g)+2D(g)
2C(g)+2D(g)
起始(mol) n n 0 0
变化(mol) 1.5 0.5 1 1
5min(mol) n-1.5 n-0.5 1 1
c(A)∶c(B)= n(A)∶n(B)= ![]() =3∶5,解得:n=3,2min末A的浓度为:
=3∶5,解得:n=3,2min末A的浓度为:![]() =0.75mol/L,故答案为:0.75mol/L;
=0.75mol/L,故答案为:0.75mol/L;
④若此后各物质的量均不再变化,则证明此可逆反应达到了化学平衡状态,也就达到了该反应的化学反应限度,故选C。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案