题目内容
下列说法正确的是
| A.根据Ksp(AgCl)=1.77×10-10,Ksp(Ag2CrO4)=1.12×10-12,可以推知AgCl的溶解度比Ag2CrO4的溶解度大 |
| B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体,最终得不到ZnS沉淀。是因为溶液中c(Zn2+)·c(S2-)>Ksp(ZnS) |
| C.向硫酸钡沉淀中加入碳酸钠溶液,沉淀发生转化,据此可推知碳酸钡的Ksp比硫酸钡的小 |
| D.AgCl在10mL 0.05mol·L-1的KCl溶液中比在20mL0.01mol·L-1的AgNO3溶液中溶解的质量少 |
D
因为氯化银和铬酸银的阴阳离子个数比不同,所以不能直接根据溶度积常数大小来比较溶解度大小。因为ZnS能溶于盐酸中,如果发生反应生成ZnS的同时,必然有盐酸生成,所以是不可能的。沉淀能否转化,关键是溶液中的离子积是否大于溶度积常数,C是错误的。氯化钾溶液中氯离子浓度大于硝酸银溶液中银离子的浓度,所以溶解的氯化银少,即D是正确的,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
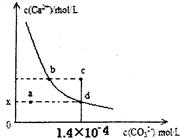
 的变化如下图所示。下列判断正确的是( )
的变化如下图所示。下列判断正确的是( ) 
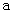 点变到
点变到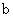 点
点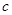
 两点代表的溶液中
两点代表的溶液中 与
与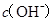 乘积不相等
乘积不相等
 Al(OH)3(aq)
Al(OH)3(aq) 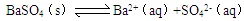 的下列说法正确的是( )
的下列说法正确的是( )