题目内容
【题目】工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:
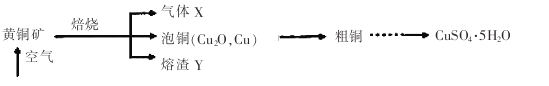
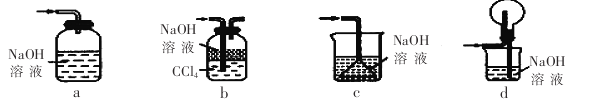
(1)下列装置不能用于吸收气体X的是_____________(填代号)。
(2)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMn04溶液、NaOH溶液、氯水。 。
(3)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中HNO3与H2SO4的最佳物质的量之比为
(4)用滴定法测定所得产品中CuSO4.5H2O的含量,称取ag样品配成100 mL溶液,取出20.00 mL,用c mol.L-l滴定剂EDTA( H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂bmL。滴定反应如下:Cu2++ H2Y2-= CuY2-+ 2H+,则CuSO4·5H2O质量分数为_____________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。(填“偏高”、“偏低”和“无影响”)
【答案】(1)ac;(2)取少量熔渣装入试管中,加入稀硫酸溶解,再向溶液中滴人高锰酸钾溶液,若溶液紫色褪去,可证明熔渣中含有FeO(说明:将稀硫酸换成稀盐酸不给分)。(3)2:3(4)(125bc)/a%;偏高
【解析】
试题分析:(1)气体X是SO2,可用NaOH溶液吸收,注意防止倒吸,装置a的广口瓶密闭,易发生危险,装置c发生倒吸,选ac。
(2)验证熔渣中含有FeO,可以利用亚铁离子的还原性,操作为:取少量熔渣,加过量稀硫酸溶解,然后向滤液中加少量KMnO4溶液,若溶液紫色退去,则说明熔渣中含有FeO。
(3)铜与稀硫酸和硝酸的混合液反应的离子方程式为3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O,由此可知当硝酸与硫酸物质的量之比为2:3时,硝酸全部转化为NO,此时溶液中溶质为CuSO4,即混酸中HNO3与H2SO4的最佳物质的量之比为2:3。
(4)根据所给反应可知n(Cu2+)=n(H2Y2-),所以CuSO4·5H2O的质量分数为(b/1000L×c mol.L-l×250g/mol)÷(ag×20mL/100mL)×100%= (125bc)/a%;滴定管用蒸馏水洗涤后,直接注入标准溶液,标准溶液被稀释,所用体积偏大,则会导致测定结果偏高。