题目内容
(2012?江苏)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
分析:A.碱性溶液中,如离子与OH-不反应,则能大量共存;
B.与CO32-反应的离子不能大量共存;
C.Fe3+可与I-、SCN-反应;
D.c(H+)/c(OH-)=1×1014的溶液呈酸性.
B.与CO32-反应的离子不能大量共存;
C.Fe3+可与I-、SCN-反应;
D.c(H+)/c(OH-)=1×1014的溶液呈酸性.
解答:解:A.碱性溶液中,离子之间不发生任何反应,则能大量共存,故A正确;
B.Ba2+与CO32-反应,不能大量共存,故B错误;
C.Fe3+可与I-、SCN-反应而不能大量共存,故C错误;
D.c(H+)/c(OH-)=1×1014的溶液呈酸性,ClO-不能在酸性条件下大量共存,故D错误.
故选A.
B.Ba2+与CO32-反应,不能大量共存,故B错误;
C.Fe3+可与I-、SCN-反应而不能大量共存,故C错误;
D.c(H+)/c(OH-)=1×1014的溶液呈酸性,ClO-不能在酸性条件下大量共存,故D错误.
故选A.
点评:本题考查离子共存问题,注意把握常见离子的性质,答题时注意把握题给条件,为解答该题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


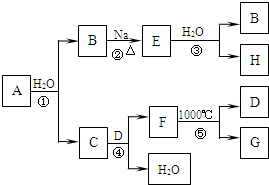 (2012?江苏一模)某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )
(2012?江苏一模)某ⅡA族元素是自然界存在最广泛的元素,常以化合物F存在,从其单质A起始发生的一系列化学反应如图所示.下列说法正确的是( )