题目内容
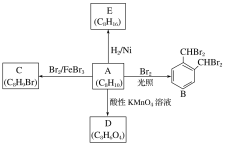
【题目】以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO、Al2O3和SiO2)为原料制备马日夫盐[Mn(H2PO4)2·2H2O(磷酸二氢锰)]的主要工艺流程如图:

(1)用MnO2“氧化”时发生反应的离子方程式为__________________________________。
(2)如何检验“沉锰”己完成_____________________________________________________。
(3)铁离子的萃取率与接触时间和溶液的pH之间的关系如图1、2所示,则应选择的接触时间为_______;pH>1.7,铁离子的萃取率急剧下降的原因可能为____________________。

(4)结合图3的溶解度曲线,请补充完整由浸锰得到的溶液制备MnSO4·H2O的实验方案:边搅拌边向溶液中滴加适量的双氧水,再向滤液中加入MnCO3粉末调节溶液的pH范围为_________,过滤洗涤,将滤液与洗涤液合并,控制温度在80℃~90℃之间蒸发浓缩、______________,(填操作名称)得到MnSO4·H2O,用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥。[已知该溶液中pH=7.8时Mn(OH)2开始沉淀:pH=5.0时Fe(OH)3、Al(OH)3沉淀完全,pH=8.8时Fe(OH)2沉淀完全]。
【答案】2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 在上层清液中继续滴加Na2CO3溶液,若无沉淀生成则说明沉锰已经完成 60min pH>1.7时铁离子水解生成Fe(OH)3沉淀 5.0≤pH<7.8 趁热过滤
【解析】
软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO、Al2O3和SiO2)用硫酸和二氧化硫进行酸溶转化为Fe2+、Fe3+、Al3+、Mn2+ SO42-,过滤后得到的滤液中含有Fe2+、Fe3+、Al3+、Mn2+ SO42-,由于SiO2不与硫酸反应,则滤渣1主要含有SiO2,向滤液中加入二氧化锰,主要作用是将滤液中的二价铁离子氧化为三价铁离子,二氧化锰自身转变为锰离子,方便杂质离子除去,再向滤液中加入有机萃取剂,将滤液中的三价铁离子转到有机萃取剂中,此时滤液中还有Al3+、Mn2+ SO42-,为确保三价铁离子除干净,同时把铝离子除净,但又不能减少滤液中锰离子的量,将调节溶液PH值调节为5到7.8之间,可将滤液中可能残留的三价铁和铝离子,全部转化为氢氧化铁和氢氧化铝沉淀。再加入碳酸钠,将锰离子转变为碳酸锰沉淀,再用磷酸溶解,最后得到马日夫盐。
(1)“氧化”时酸性溶液中二氧化锰与亚铁离子反应生成三价铁离子,离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(2)若锰离子全部沉淀,那么溶液中再加入碳酸钠就不会产生沉淀,因此检验方法为在上层清液中继续滴加Na2CO3溶液,若无沉淀生成则说明沉锰已经完成;
答案为:取沉淀后的上层清液中继续滴加Na2CO3溶液,若无沉淀生成则说明沉锰已经完成;
(3)如图一所示,当接触60分钟时,萃取率达到最大,当pH>1.7时,Fe3+会发生水解转化为氢氧化铁沉淀,导致铁离子萃取率降低;
答案为:60min;pH>1.7时铁离子水解生成Fe(OH)3沉淀;
(4)实验目的是制备MnSO4·H2O,要将杂质离子处理干净,当PH=5时铁离子完全沉淀,结合已知条件溶液中pH=7.8时Mn(OH)2开始沉淀,溶液中锰离子的量就会减少,因此溶液的PH控制在5到7.8之间,杂质离子最少,溶液中锰离子的含量最高;根据图三所示,当溶液中温度为23.9℃左右,MnSO4·H2O的溶液度最大,温度越高,MnSO4·H2O晶体析出越多,趁热过滤得到的产品的产率最高;
答案为:5.0≤pH<7.8;趁热过滤。

【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度