题目内容
 有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.
有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.
【探究目的】实验测定样品中NaHCO3和KHCO3物质的量之比.
【探究思路】设计实验测量有关反应物和生成物的量,并通过计算确定样品中NaHCO3和KHCO3物质的量之比.
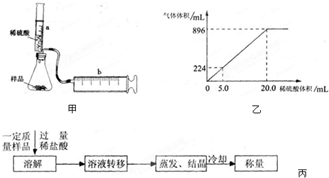
【实验探究】实验装置如图甲所示.将一定质量的混合物样品加入锥形瓶中,用针筒a注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒管壁间的摩擦).
如果往锥形瓶中注入的稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积为______mL.写出锥形瓶中反应的离子方程式______.
【结果处理】锥形瓶中放有混合均匀的NaHCO3和KHCO3的样品3.6g,向锥形瓶中滴入一定量的稀硫酸,生成的气体体积(已换算成标准状况)与加入的稀硫酸的体积关系如图乙所示:
(1)实验所用稀硫酸中溶质的物质的量浓度是______ mol/L.
(2)样品中NaHCO3和KHCO3物质的量之比为______.
【拓展探究】某同学设计了另一种方案,其操作流程如图丙:在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHCO3和KHCO3物质的量之比______(选填“偏大”、“偏小”或“不变”).
故答案为:V2-V1;HCO3-+H+=H2O+CO2↑;
结果处理:(1)设硫酸溶液的体积为浓度为xmol/L,由图象可知,消耗硫酸20mL,生成标况下的二氧化碳体积896mL,二氧化碳的物质的量为:
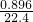 mol=0.04mol,
mol=0.04mol,根据反应:HCO3-+H+=H2O+CO2
1mol 1mol
2x×0.02 0.04
列式:1mol×0.04=2x×0.02×1mol
解得x=1mol/L,
故答案为:1mol/L;
(2)设碳酸氢钠物质的量为xmol,碳酸氢钾物质的量为y,
根据二氧化碳物质的量列式:x+y=0.04,
根据质量关系列式:84x+100y=3.6
解得:x=0.025,y=0.015,
x:y=0.025:0.015=5:3,
故答案为:5:3;
拓展探究:如果在转移溶液时,如果溶液转移不完全,最后称量的固体质量偏小,导致计算出碳酸氢钠的物质的量偏小,碳酸氢钾的物质的量偏大,二者物质的量比值会偏小,故答案为:偏小.
分析:实验探究:题目给出了相对复杂的解题信息,给出了一些复杂的数据,但是如果认真提炼会发现第一问其实生成的二氧化碳的体积,由于在密闭体系中注入V1mL的硫酸,导致此时注射器中也应该为V1mL才能维持内部压强相等,所以后来生成的气体会导致体积在V1mL的基础上增大(硫酸消耗引起的体积变化可以忽略不计),所以二氧化碳的体积为两者的差;锥形瓶中发生的反应是碳酸氢钠、碳酸氢钾与稀硫酸的反应;
结果处理:(1)根据图象及反应方程式计算出硫酸的物质的量浓度;
(2)设出二者物质的量,然后根据生成的总的二氧化碳的物质的量及碳酸氢钠和碳酸氢钾的质量列式计算即可;
拓展处理:在转移溶液时,如果溶液转移不完全,会导致最后一步处理的质量减小,计算出碳酸氢钠的物质的量偏小,碳酸氢钾的物质的量偏大,比值会偏小.
点评:本题主要考查了测定样品中NaHCO3和KHCO3物质的量之比的方法,涉及了关于化学式的一些计算,难度不大,要加强理解记忆.

 特高级教师点拨系列答案
特高级教师点拨系列答案(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
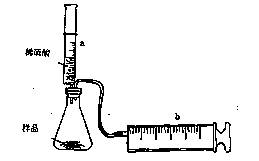 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
|
|
50mL稀硫酸 |
50mL稀硫酸 |
50mL稀硫酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
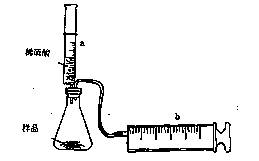 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
|
| 50mL稀硫酸 | 50mL稀硫酸 | 50mL稀硫酸 |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
①稀硫酸的物质的量浓度为1.5mol/L
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:
在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
(8分)有一包NaHCO3和KHCO3的混合物样品。某研究性学习小组对其进行如下探究。实验装置如图所示。将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)
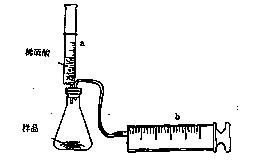 |
(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2 mL,则反应中生成的CO2气体体积为 mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相矧),下列分析推理错误的是 。
| | 50mL稀硫酸 | 50mL稀硫酸 | 50mL稀硫酸 |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
②15.7 g混合物恰好与稀硫酸完全反应
③加入混合物9.2 g时稀硫酸未反应完
④计算出样品中NaHC03和KHC03物质的量之比为1:1
(3)某同学设计了另一种方案,其操作流程如下:

在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比 (选填“偏人”、“偏小”或“不变”)。
 有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.
有一包NaHCO3和KHCO3的混合物样品.某研究性学习小组对其进行了如下探究,请按要求完成下列探究报告.