题目内容
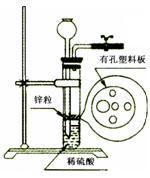
某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不均时会生成Fe3O4,也能被磁铁吸引。为了探究X的组成,他们进行了如下实验。
I、定性检验
由上述实验现象推断,黑色粉末X的成分是 。
II、定量测定
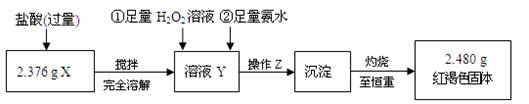
⑴ 操作Z的名称是 ,如图19的仪器中,在灼烧沉淀时必须用到的是 (填字母)。
⑵ 写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:
。
⑶ 将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1- b2= 0.3 g,则接下来还应进行的操作是
。
⑷ 有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示):
。
⑸ 通过以上数据,得出2.376 g黑色粉末中各成分的物质的量为 。
I、定性检验
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生 |
| ② | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少 量红色物质析出,仍有较多黑色固体未溶解 量红色物质析出,仍有较多黑色固体未溶解 |
由上述实验现象推断,黑色粉末X的成分是 。
II、定量测定

⑴ 操作Z的名称是 ,如图19的仪器中,在灼烧沉淀时必须用到的是 (填字母)。

⑵ 写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:
。
⑶ 将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1- b2= 0.3 g,则接下来还应进行的操作是
。
⑷ 有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示):
。
⑸ 通过以上数据,得出2.376 g黑色粉末中各成分的物质的量为 。
Ⅰ Fe 、 Fe3O4
Ⅱ ⑴ 过滤、洗涤 (只选过滤得1分) A C E F
⑵ 2Fe2+ + H2O2+ 2H+=== 2Fe3+ 2H2O
⑶ 再次加热并置于干燥器中冷却,称量,直至两次的质量差不超过0.1g为止。
⑷ 4Fe(OH)2+ O2+ 2H2O === 4Fe(OH)3
⑸ n(Fe) = 0.001 mol n(Fe3O4) = 0.01 mol
Ⅱ ⑴ 过滤、洗涤 (只选过滤得1分) A C E F
⑵ 2Fe2+ + H2O2+ 2H+=== 2Fe3+ 2H2O
⑶ 再次加热并置于干燥器中冷却,称量,直至两次的质量差不超过0.1g为止。
⑷ 4Fe(OH)2+ O2+ 2H2O === 4Fe(OH)3
⑸ n(Fe) = 0.001 mol n(Fe3O4) = 0.01 mol
略

练习册系列答案
相关题目
 色到 色;
色到 色;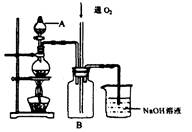
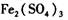 作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节
作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节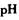 ,产生
,产生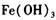 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作
沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作 催化剂循环使用。
催化剂循环使用。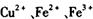 分别生成沉淀的pH如下:
分别生成沉淀的pH如下: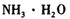 b.
b. c.
c.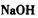 d.
d.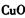
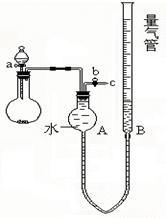
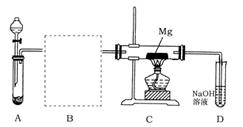
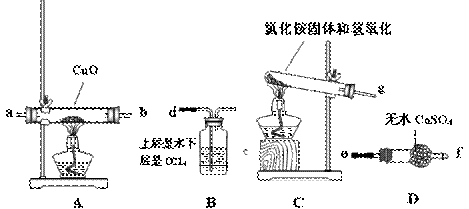 ①请你根据提供的装置从左至右连接接口序号( )()( )( )( )( )
①请你根据提供的装置从左至右连接接口序号( )()( )( )( )( )