题目内容
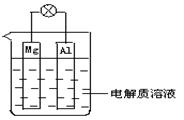
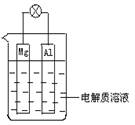
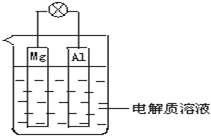 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):(1)电解质溶液为稀H2SO4时,灯泡
亮
亮
(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).a.若灯泡亮,则Mg电极上发生的反应为:
Mg-2e-=Mg2+
Mg-2e-=Mg2+
;Al电极上发生的反应为:2H++2e-=H2↑
2H++2e-=H2↑
.b.若灯泡不亮,其理由为:.
(2)电解质溶液为NaOH(aq)时,灯泡
亮
亮
(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).a.若灯泡亮,则Mg电极上发生的反应为:
6H2O+6e-=3H2+6OH-
6H2O+6e-=3H2+6OH-
;Al电极上发生的反应为:2Al-6e-+8OH-=2AlO2+4H2O
2Al-6e-+8OH-=2AlO2+4H2O
.b.若灯泡不亮,其理由为:.
分析:(1)金属镁和铝为电极材料,电解质溶液为稀H2SO4时,可形成原电池,金属镁较铝活泼,做原电池的负极,铝做原电池的正极,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑;
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于金属铝能与氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,所以铝为负极,镁为正极,
负极反应为2Al-6e-+8OH-=2AlO2+4H2O,正极反应为6H2O+6e-=3H2+6OH-.
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于金属铝能与氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,所以铝为负极,镁为正极,
负极反应为2Al-6e-+8OH-=2AlO2+4H2O,正极反应为6H2O+6e-=3H2+6OH-.
解答:解:(1)金属镁和铝为电极材料,电解质溶液为稀H2SO4时,可形成原电池,金属镁较铝活泼,做原电池的负极,铝做原电池的正极,负极反应为Mg-2e-=Mg2+,
正极反应为2H++2e-=H2↑,此时灯泡变亮,故答案为:亮;Mg-2e-=Mg2+;2H++2e-=H2↑;
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于金属铝能与氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,所以铝为负极,镁为正极,
负极反应为2Al-6e-+8OH-=2AlO2+4H2O,正极反应为6H2O+6e-=3H2+6OH-,形成原电池时,灯泡变亮,
故答案为:亮;6H2O+6e-=3H2+6OH-;2Al-6e-+8OH-=2AlO2+4H2O.
正极反应为2H++2e-=H2↑,此时灯泡变亮,故答案为:亮;Mg-2e-=Mg2+;2H++2e-=H2↑;
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于金属铝能与氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,所以铝为负极,镁为正极,
负极反应为2Al-6e-+8OH-=2AlO2+4H2O,正极反应为6H2O+6e-=3H2+6OH-,形成原电池时,灯泡变亮,
故答案为:亮;6H2O+6e-=3H2+6OH-;2Al-6e-+8OH-=2AlO2+4H2O.
点评:本题考查原电池的原理以及电极反应式的书写,题目难度不大,本题注意电解质不同时,电极反应不同.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目