题目内容
虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
① KMnO4 + KF + H 2O2 + HF → K2Mn F6 + ____________ + H2O
2O2 + HF → K2Mn F6 + ____________ + H2O
② SbCl5 + HF → SbF5 + ____________
③ 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为______________,为什么填这一物质,试用氧化还原反应理论解释_______________________________________。
(2)完成反应②:_______________________________________________ 。
。
 (3)反应③中的氧化剂为________________,被氧化的元素为________________。
(3)反应③中的氧化剂为________________,被氧化的元素为________________。
(4)配平反应①,并标出电子转移的方向和数目。(将答案写在下面空格上)
________________________________________________________。
① KMnO4 + KF + H
 2O2 + HF → K2Mn F6 + ____________ + H2O
2O2 + HF → K2Mn F6 + ____________ + H2O② SbCl5 + HF → SbF5 + ____________
③ 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为______________,为什么填这一物质,试用氧化还原反应理论解释_______________________________________。
(2)完成反应②:_______________________________________________
 。
。 (3)反应③中的氧化剂为________________,被氧化的元素为________________。
(3)反应③中的氧化剂为________________,被氧化的元素为________________。(4)配平反应①,并标出电子转移的方向和数目。(将答案写在下面空格上)
________________________________________________________。
(1)O2(1分),KMnO4中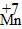 化合价降低,则H2O2必作还原剂(1分)
化合价降低,则H2O2必作还原剂(1分)
(2)SbCl5 + 5HF→SbF5 + 5HCl(1分)
(3)K2MnF6(1分),负一价的F(1分)
(4)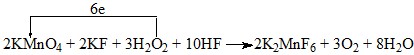
(3分,其中电子转移的数目与方向各1分)
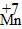 化合价降低,则H2O2必作还原剂(1分)
化合价降低,则H2O2必作还原剂(1分)(2)SbCl5 + 5HF→SbF5 + 5HCl(1分)
(3)K2MnF6(1分),负一价的F(1分)
(4)
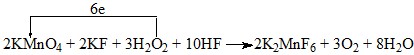
(3分,其中电子转移的数目与方向各1分)
略

练习册系列答案
相关题目
 _____ __是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为______ _mol,被氧化的物质有 mol。
_____ __是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为______ _mol,被氧化的物质有 mol。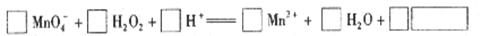

 氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)