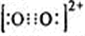题目内容
(1)A+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图(1)所示。A的元素符号是___________,与同一个N3-相连的A+有__________个;
(2)如图(2)所示,RCl用作有机机合成催化剂,并用于颜料, 防腐等工业。Cl-的配位数是___________。
(2)如图(2)所示,RCl用作有机机合成催化剂,并用于颜料, 防腐等工业。Cl-的配位数是___________。

(1)Cu ; 6
(2)4
(2)4

练习册系列答案
相关题目
化合物A是近年来采用的锅炉水添加剂,其结构简式如图,A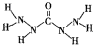 能除去锅炉水中溶解的氧气,下列说法正确的是( )
能除去锅炉水中溶解的氧气,下列说法正确的是( )
 能除去锅炉水中溶解的氧气,下列说法正确的是( )
能除去锅炉水中溶解的氧气,下列说法正确的是( )| A、A分子中所有原子都在同一平面内 | B、A分子中所含的O-键与π键个数之比为10:1 | C、1 mol A所含有的电子数为44NA(NA表示阿伏伽德罗常数) | D、1 molA与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3 |
 (1)下列是部分金属元素的电离能
(1)下列是部分金属元素的电离能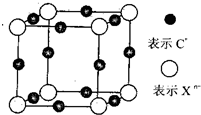 (2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
(2009?深圳二模)前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题: 确定物质性质的重要因素是物质结构.请回答下列问题.
确定物质性质的重要因素是物质结构.请回答下列问题.